食道癌
切除不能進行または再発食道癌(腺癌または扁平上皮癌)に対する、Pembrolizumabと担当医師選択薬(Paclitaxel、DocetaxelまたはIrinotecan)を比較した第III相試験(KEYNOTE-181試験)
Pembrolizumab versus chemotherapy as second-line therapy for advanced esophageal cancer: The phase 3 KEYNOTE-181 study
Takashi Kojima, et al.
Expert’s view
食道癌にとって初めての免疫チェックポイント阻害剤によるポジティブな第III相試験の結果であり、新しい時代の到来を告げる、大変意義深い試験結果である。グローバル試験で行われたため、扁平上皮癌および腺癌が登録されたが、前相試験であるKEYNOTE-180試験では、組織型や、CPSによるPD-L1の発現割合により有効性が異なることが分かった。181試験では、当初より、全体でのOS、扁平上皮癌でのOS、そしてバイオマーカーでセレクションした集団でのOSの3つを主要評価項目としていたが、当初はGene Expression Profile(GEP)を用いる予定であったマーカーは改訂され、CPS≧10となった経緯がある。そのためCPS≧10は層別因子となっておらず、結果として、扁平上皮癌患者、アジア人患者、PS 0患者と、より有利な集団がより多い割合でPembrolizumab群に登録されていることが指摘されている。また、CPS≧10集団のサブグループ解析での腺癌症例群のHRが1に近く、果たしてCPS≧10であっても腺癌に有効なのか?という疑問は残っている。
また、本年1月9日に、Nivolumabも食道癌二次化学療法において、Taxane系薬剤に対する生存期間の優越性を示したというプレスリリースがあり、食道癌にて免疫チェックポイント阻害剤が日常診療で使われる時代が到来したこととなる。現在初回化学療法例を対象とした試験も行われており、さらなる発展が期待される。
(コメント・監修:国立がん研究センター中央病院 消化管内科 医長 加藤 健)
一次化学療法に不応となった食道癌の患者は予後不良
食道癌はアジアとアフリカでは扁平上皮癌が多く、北アメリカと西ヨーロッパでは腺癌が多く地域によって主要な組織型が異なる。一次化学療法に不応となった食道癌の患者は予後不良であり、また治療の選択肢も少ないが、第II相試験(KEYNOTE-180試験)では、食道癌の3次治療以降としてPembrolizumabは扁平上皮癌で奏効割合14.8%、腺癌扁平上皮癌含めたPD-L1陽性例[CPS(combined positive score)≧10]で奏効割合13.8%を認め有用性が示唆された1)。
化学療法単独療法に対するPembrolizumab療法の優越性を検証
本試験では628名が登録され(うち401名が扁平上皮癌、222名がCPS≧10)、Pembrolizumab 200mg 3週毎投与群と担当医師選択薬群(Paclitaxel、Docetaxel、Irinotecan)とに1:1で割り付けられた。主要評価項目は、ITT解析による全患者での生存期間(OS)、扁平上皮癌患者でのOS、PD-L1発現CPS≧10患者におけるOS、の3つであった。
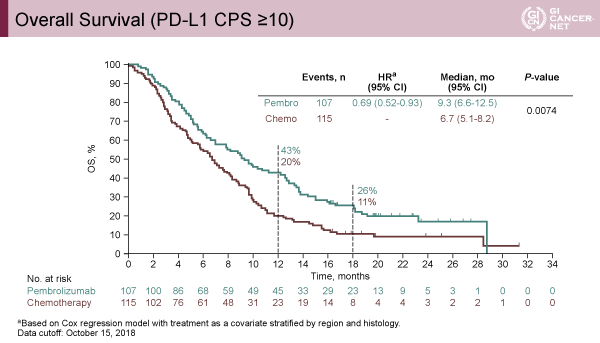
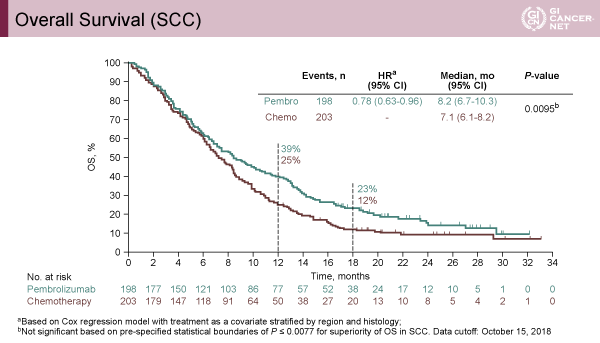
2018年10月15日時点で観察期間中央値はPembrolizumab群で7.1ヵ月、担当医師選択薬群で6.9ヵ月であった。CPS≧10の症例におけるOS中央値は、Pembrolizumab群(9.3ヵ月)は担当医師選択薬群(6.7ヵ月)と比較して統計学的な有意差をもって良好であった[HR=0.69(95% CI: 0.52-0.93)、p=0.0074](図1)。またCPS≧10の症例での1年生存割合は43%と20%であった。扁平上皮癌コホートにおけるOS中央値は、Pembrolizumab群8.2ヵ月、担当医師選択薬群7.1ヵ月と臨床的に改善が認められた[HR=0.78(95% CI: 0.63-0.96)、p=0.0095]。本試験は主要評価項目が3つであったために全体のα=0.25が、扁平上皮癌コホートの検定に0.008、CPS≧10コホートの検定に0.009、全患者の検定に0.008と割り付けられており、P値は0.0077以下でないと有意とはならない設定であったため、統計学的には有意差を示せなかった(図2)。ITTでの全患者OS中央値はPembrolizumab群7.1ヵ月、医師選択薬群7.1ヵ月と2群間で有意な差を示せなかった[HR=0.89(95% CI: 0.75-1.05)p=0.0560]。
治療関連有害事象の発現は、Pembrolizumab群では全てのGrade 64.3%、Grade 3-5 18.2%、治療関連死1.5%、医師選択薬群では全てのGrade 86.1%、Grade 3-5 40.9%、治療関連死1.7%と、むしろPembrolizumab群で少なかった。
発表者の許可を得て掲載(approved by Takashi Kojima)
発表者の許可を得て掲載(approved by Takashi Kojima)
まとめ
PembrolizumabはPD-L1 CPS≧10の食道癌における2次治療として化学療法単独に対してOSの有用性が証明され、またより安全に投与を行うことができた。これらのデータをもとに食道癌のPD-L1出現がCPS≧10の症例の2次治療の標準治療としてPembrolizumabが推奨される。
(レポート:国立がん研究センター中央病院 消化管内科 青木 雅彦)
Reference
- 1) Shah MA, et al.: J Clin Oncol. 36(15_suppl): Abstract #4049, 2018







加藤 健先生
国立がん研究センター中央病院 消化管内科 医長