2018年1月18日~20日に米国サンフランシスコにて開催された2018年 消化器癌シンポジウム(2018 Gastrointestinal Cancers Symposium)より、大腸癌や胃癌、肝細胞癌などの注目演題のレポートをお届けします。演題レポートの冒頭には“Expert's view”として、臨床研究の第一線で活躍する監修ドクターのコメントを掲載しています。
肝細胞癌
切除不能肝細胞癌に対する肝動脈化学塞栓療法(TACE)+Sorafenib併用療法とTACE単独の非盲検多施設共同無作為化比較第II相試験(TACTICS試験)
Randomized, open label, multicenter, phase II trial of Transcatheter Arterial Chemoembolization (TACE) Therapy In Combination with Sorafenib as compared with TACE alone in patients with hepatocellular carcinoma: TACTICS trial
Masatoshi Kudo, et al.
Expert’s view

上野 誠先生
神奈川県立がんセンター 消化器内科 医長
TACTICSと呼ばれるTACE治療中にSorafenib併用療法の有効性を検討する無作為化第II相試験の結果が近畿大学の工藤正俊先生より報告された。TACE治療中の全身化学療法の臨床試験は、過去に三つ行われたが、いずれも有効性を示すことができず、TACEのタイミング(決められた間隔か、on demandと呼ばれる腫瘍増悪時か)、全身化学療法の服用時期、endpointをどのように設定するかが議論されてきた。今回は、on demand TACEが行われ、SorafenibはTACEの前後数日のみ休薬、主要評価項目は、TACE施行可能な期間は腫瘍再発があってもイベントとしない無増悪生存期間(PFS)と設定された(詳細は発表内容参照)。本試験では、PFSで優位な差が認められた一方で、イベント数不足により全生存期間の解析がなされていないこと、過去の試験では、有効性を示せなかったことから、現時点でTACE治療中の標準治療が無治療経過観察から変わったとはいえない。今後、本邦で同療法の第III相試験が行われることを是非、期待したい。またTACE併用の臨床試験においてどのようなエンドポイントを設定するか、以前より多くの議論がなされてきたが、本試験で設定されたPFSは興味深く、今後、肝細胞癌TACE併用全身化学療法の重要な指標になり得る可能性がある。
(コメント・監修:神奈川県立がんセンター 消化器内科 医長 上野 誠)
TACE+Sorafenibの過去の試験結果
TACE後に腫瘍組織中のVEGFが増加することが示されており1)、VEGFR阻害薬であるSorafenibをTACE後に投与することでTACE後の腫瘍増悪を抑えることできるのではないかと考えられている2)。多発肝細胞癌に対してTACE単独を繰り返す治療法とTACE後にSorafenibを投与しながらTACEを繰り返す治療法を比較する試験がこれまでに3つ行われているが、いずれの試験においても主要評価項目である腫瘍増悪までの期間(TTP)もしくは無増悪生存期間(PFS)の有意な延長は示されなかった。これらの試験ではSorafenibの投与期間を保てなかったことがネガティブな結果につながったのではないかと指摘されている。今回の試験ではTACEとSorafenibの併用療法の意義について新しいエンドポイントを用いて評価した。
TACEとTACE+Sorafenibの非盲検無作為化比較第II相試験
切除不能で腫瘍個数10個以下、最大腫瘍径10cm以下の肝細胞癌患者を対象とした。肝外転移や主要脈管侵襲を有する患者は除外した。患者は無作為化され、TACEのみを繰り返す群と、TACEの2~3週前からSorafenibを併用しながらTACEを繰り返す群に割り付けられた。TACEは担当医が必要と判断するタイミングで施行し(on demand TACE)、Sorafenibは400mg 1日1回で開始し、400mg 1日2回に増量して継続した。TACEの前後数日はSorafenibを休薬した。主要評価項目はPFSと全生存期間(OS)であり、Gatekeeping strategyにより多重性に対応しPFSが有意に良好であったときのみにOSに関する検定を行うこととした。有意水準はPFS、OSともに片側15%、検出力は80%であり必要なイベント数は125としている。PFSのイベントの定義は25%以上の腫瘍増大、2回続けてTACEの効果が不良(50%以上の腫瘍残存)、2回続けてTACE後に腫瘍数が増加、主要脈管侵襲の出現、肝外転移の出現、Child-Pugh C以上への肝機能増悪、もしくは死亡のいずれかと定義した。
Sorafenib併用によりPFSは有意に延長した
日本国内の33施設から156人の患者が登録され、Sorafenib併用群に80人、TACE単独群に76人が割り付けられた。登録された全患者が有効性の解析対象となった(ITT解析)。患者背景はSorafenib併用群/TACE単独群でそれぞれ、BCLCステージBが67.5%/64.5%、ミラノ規準を超えるものが67.5%/59.2%、AFP 200ng/mL未満が80.0%/78.9%、Child-Pughスコア5が80.0%/71.1%であった。
主要評価項目の一つであるPFSは中央値でSorafenib併用群が25.2ヵ月、TACE単独群が13.5ヵ月でありハザード比は0.59[95%信頼区間(CI): 0.41-0.87、p=0.006]とSorafenib併用群で有意に良好であった(図1)。
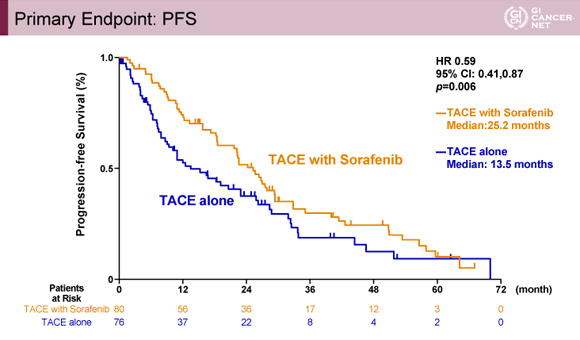
発表者の許可を得て掲載(approved by Masatoshi Kudo)
もう一つの主要評価項目であるOSは必要イベント数125に達しておらず(この時点で92)、今回はpreliminaryな結果が示された。OSのカプランマイヤー曲線はSorafenib併用群のほうがTACE単独群よりも良好な傾向であった(図2)。
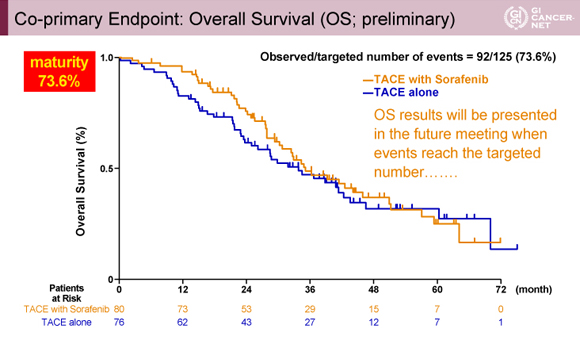
発表者の許可を得て掲載(approved by Masatoshi Kudo)
今後、必要イベント数に達した際にOSの最終結果を解析し報告する予定である。
有害事象はSorafenib併用群においてgrade 3の血小板減少が12.8%、全gradeの手足症候群が52.6%、高血圧が51.3%、倦怠感が24.4%、下痢が14.1%などの頻度で出現しTACE単独群より高頻度であった。
Sorafenib投与量の中央値は355.2mg/日、投与期間の中央値は38.7週であった。過去に行われたTACEにSorafenibを併用する試験でのSorafenib投与期間は17~21週であり3-5)、今回の試験ではSorafenibの投与期間が長く保たれていた。
まとめ
多発肝細胞癌に対してTACEにSorafenibを併用することでPFSが有意に良好となることが示された。今回のOSはpreliminaryな結果でありOSの最終結果は今後発表する予定である。
(レポート:国立がん研究センター東病院 肝胆膵内科 医員 高橋 秀明)
References
- 1) Wang B, et al.: Acta Radiol. 49(5): 523-529, 2008[PubMed]
- 2) Pawlik TM, et al.: J Clin Oncol. 29(30): 3960-3967, 2011[PubMed]
- 3) Kudo M, et al.: Eur J Cancer. 47(14): 2117-2127, 2011[PubMed]
- 4) Lencioni R, et al.: J Hepatol. 64(5): 1090-1098, 2016[PubMed]
- 5) Meyer T et al.: Lancet Gastroenterol Hepatol. 2(8): 565-575, 2017[PubMed]

監修・レポーター
監修
谷口 浩也先生
愛知県がんセンター中央病院 薬物療法部 医長
レポーター
賀川 義規先生
関西ろうさい病院 下部消化器外科 副部長
#745
監修
山﨑 健太郎先生
静岡県立静岡がんセンター 消化器内科 医長
レポーター
山本 祥之先生
筑波大学附属病院 消化器内科 病院講師
#557
監修
上野 誠先生
神奈川県立がんセンター 消化器内科 医長
レポーター
高橋 秀明先生
国立がん研究センター東病院 肝胆膵内科 医員
#207