2018年1月18日~20日に米国サンフランシスコにて開催された2018年 消化器癌シンポジウム(2018 Gastrointestinal Cancers Symposium)より、大腸癌や胃癌、肝細胞癌などの注目演題のレポートをお届けします。演題レポートの冒頭には“Expert's view”として、臨床研究の第一線で活躍する監修ドクターのコメントを掲載しています。
胃癌
転移性胃/食道胃接合部腺癌患者を対象とした一次治療としてのCapecitabine+Cisplatin併用療法とCapecitabine+Cisplatin+Ramucirumab併用療法の無作為化二重盲検プラセボ対照第III相試験(RAINFALL)
RAINFALL: A randomized, double-blind, placebo-controlled phase 3 study of cisplatin (Cis) plus capecitabine (Cape) or 5FU with or without ramucirumab (RAM) as first-line therapy in patients with metastatic gastric or gastroesophageal junction (G-GEJ) adenocarcinoma
Charles S. Fuchs, et al.
Expert’s view

山﨑 健太郎先生
静岡県立静岡がんセンター 消化器内科 医長
血管新生は多くの癌種で腫瘍の浸潤や転移、再発および予後に関連することから、これまでに血管内皮増殖因子およびその受容体を標的とした治療薬の開発が数多く行われ、さまざまな癌種で有効性を示してきた。血管内皮増殖因子受容体2(VEGFR-2)に対する抗体薬であるRamucirumabもその一つで、胃癌、肺癌、大腸癌既治療例に対して生存期間延長効果を示し標準治療の一つとなっている。本試験ではHER2陰性切除不能胃癌初回治療例の標準治療であるCapecitabine+Cisplatin療法に対するRamucirumab併用の有用性が検討された。主要評価項目である無増悪生存期間はRamucirumab併用群で有意に良好であったものの、その他の抗腫瘍効果の指標である全生存期間、奏効率、病勢コントロール率には両群間で有意差を認めなかった。全生存期間のサブグループ解析においてもRamucirumab併用療法の有用性が示唆されるサブグループは見出せず、今後のバイオマーカー解析に期待したいところである。
本試験の結果より、残念ながら切除不能胃癌初回治療例に対するRamucirumab併用療法を標準治療と位置付けることは難しいが、既治療例に対する単剤およびPaclitaxelとの併用療法の標準治療としての位置付けはREGARD試験1)、RAINBOW試験2)の結果より揺るぎないものと考える。
(コメント・監修:静岡県立静岡がんセンター 消化器内科 医長 山﨑 健太郎)
HER2陰性胃癌1次治療におけるRamucirumab併用療法を評価
Ramucirumabは血管内皮増殖因子受容体2(VEGFR-2)に対するIgG1モノクローナル抗体である。転移性胃/食道胃接合部腺癌に対してRamucirumab単独療法は、フッ化ピリミジン系薬剤またはプラチナ製剤を含む併用化学療法施行後の2次治療以降の胃癌患者に対して、プラセボ群と比較して有効性が示され(REGARD試験)1)、Paclitaxelとの併用療法は、フッ化ピリミジン系薬剤とプラチナ製剤の併用療法が無効後の2次治療として、Paclitaxel+プラセボ群と比較して有効性が示された(RAINBOW試験)2)。現在、Ramucirumabは2次治療以降におけるキードラッグの1つとなっている。本試験は、HER2陰性胃癌の1次治療における標準治療(フッ化ピリミジン系薬剤+プラチナ製剤)へのRamucirumabの併用効果を検証した国際共同二重盲検無作為化比較第III相試験である。
主要評価項目は無増悪生存期間
対象は、1次治療としての全身化学療法歴を有さないECOG PS 0-1のHER2陰性の転移性胃/食道胃接合部腺癌患者であった。治療方法は、標準治療としてCapecitabine(内服困難例では5-FUに代替許容)+Cisplatin療法(XP/FP療法)[Capecitabine 2,000mg/m2(day 1-14)/5-FU 800mg/m2(day 1-5)+Cisplatin 80mg/m2(day 1)、3週毎]に加えて、介入群はRamucirumab(8mg/kg)を3週毎にday 1, 8に静脈投与され、対照群はプラセボ薬をRamucirumabと同様のスケジュールで投与された。Ramucirumabの3週毎day 1, 8投与(8mg/kg)の血中薬物濃度は、Paclitaxel併用療法における2週毎day 1投与(8mg/kg)と同等であることが、胃癌に対するフッ化ピリミジン系薬剤+プラチナ製剤との併用投与における第Ib相試験の薬物動態試験で明らかになっている3)。Cisplatinは6サイクルを上限に投与され、Capecitabine+Ramucirumab/プラセボ薬は病勢進行もしくは継続不可能な毒性出現まで繰り返し投与された(図1)。
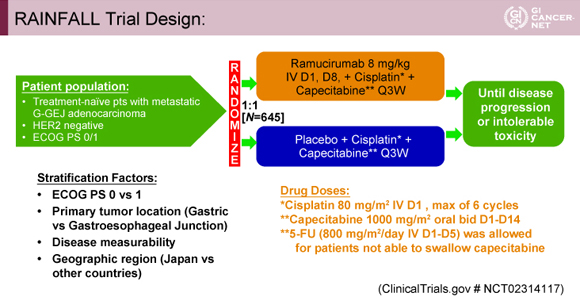
発表者の許可を得て掲載(approved by Charles S. Fuchs)
主要評価項目は無増悪生存期間(PFS)であり、副次評価項目は全生存期間(OS)、奏効率および治療期間、安全性、QOL、薬物動態プロファイルであった。試験は、PFSの期待ハザード比(HR)0.70、両側α=0.05、検出力90%で計画され必要イベント数346例、OSに関しては期待HRが0.77、両側α=0.05、検出力80%で計画され必要イベント数467例であり、目標登録数616例として実施された。なお事前に、主要評価項目のPFSの解析は359例のイベントが観察された時点で行うこととし、最終OSの解析は470例のイベントが観察された時点で行うことが規定されていた。
PFSの有意な延長が示されたが、OSの延長は示されなかった
19ヵ国より計645例が登録され(ITT population)、Ramucirumab+XP/FP群に326例、プラセボ+XP/FP群に319例が1:1に無作為化された。患者背景に偏りはなく、年齢中央値はRamucirumab+XP/FP群60歳、プラセボ+XP/FP群62歳、ECOG PS 1はそれぞれ57%、55%で、原発部位(食道胃接合部/胃)はそれぞれ26%/74%、25%/75%であり、組織型(Diffuse/Intestinal)はそれぞれ43%/33%、41%/30%であった。
主要評価項目のPFSの中央値は、Ramucirumab+XP/FP群5.72ヵ月、プラセボ+XP/FP群5.39ヵ月、HRは0.75(95% CI: 0.61-0.94)であり、統計学的に優越性が示された(p=0.011)(図2)。
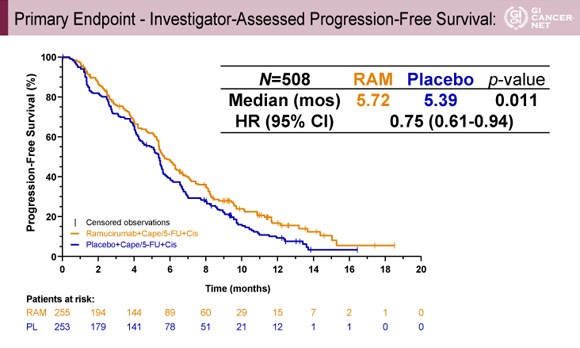
発表者の許可を得て掲載(approved by Charles S. Fuchs)
一方、OSの中央値は、Ramucirumab+XP/FP群11.17ヵ月、プラセボ+XP/FP群10.74ヵ月、HRは0.96(95% CI: 0.80-1.16)であり、統計学的に有意差は認められなかった(p=0.68)(図3)。
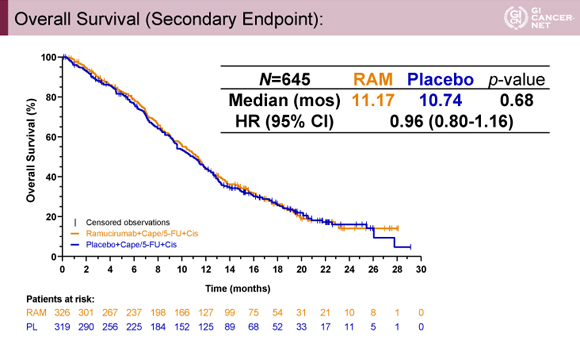
発表者の許可を得て掲載(approved by Charles S. Fuchs)
奏効率は、Ramucirumab+XP/FP群41%、プラセボ+XP/FP群36%であり、有意差を認めなかった(p=0.17)。病勢コントロール率も82% vs. 77%と同様の結果であった(p=0.10)。治療サイクル中央値は、両群とも6.0サイクルであり、治療期間中央値はRamucirumab+XP/FP群19.0週、プラセボ+XP/FP群18.8週であった。相対用量強度(RDI)はRamucirumab+XP/FP群90.3%(45.4-107.7)、プラセボ+XP/FP群92.4%(45.4-108.0)であった。
安全性の評価は実際に薬剤が投与された638例を対象に行われ、有害事象は、Ramucirumab+XP/FP群 vs. プラセボ+XP/FP群でそれぞれ、好中球減少(全grade/grade≧3):54%/26% vs. 53%/27%、白血球減少:14%/5.0% vs. 12%/5.4%、貧血:34%/12% vs. 37%/14%、血小板減少:34%/7.7% vs. 19%/3.5%、疲労:59%/8.4% vs. 58%/7.9%、腹痛:26%/5.6% vs. 23%/3.5%、手足症候群:31%/8.7% vs. 20%/3.8%、食欲不振:41%/6.5% vs. 32%/3.2%、発熱性好中球減少:3.7%/3.7% vs. 5.1%/5.1%などであり、血小板減少、手足症候群、食欲不振に関してはRamucirumab+XP/FP群で頻度が高い傾向にあった。また、Ramucirumabに関連した有害事象としては、高血圧:22%/9.9% vs. 7.3%/1.6%、蛋白尿:19%/2.5% vs. 11%/0.6%、消化管穿孔:4.3%/4.0% vs. 0.6%/0.3、出血:25%/3.4% vs. 14%/4.1%などがRamucirumab+XP/FP群で頻度が高い傾向にあった。
後治療は、Ramucirumab+XP/FP群で46%、プラセボ+XP/FP群で51%の症例に実施されており、使用薬剤はそれぞれRamucirumabが12%/17%、Irinotecanが8.0%/13%、Paclitaxelが23%/30%、免疫チェックポイント阻害剤が5.5%/2.8%であった。探索的研究として、2次治療でのRamucirumab(RAM)併用の有無に分けた2×2の4群でのOS解析が行われた(統計学的な検証はなし)。無作為化からのOS中央値は、【1st RAM+/2nd RAM+】群は16.2ヵ月、【1st RAM+/2nd RAM-】群は13.2ヵ月、【1st RAM-/2nd RAM+】群は14.9ヵ月、【1st RAM-/2nd RAM-】群は13.0ヵ月であった。また、2次治療開始からのOS中央値は、【1st RAM+/2nd RAM+】群は7.7ヵ月、【1st RAM+/2nd RAM-】群は6.5ヵ月、【1st RAM-/2nd RAM+】群は8.8ヵ月、【1st RAM-/2nd RAM-】群は6.7ヵ月であった。
まとめ
転移性HER2陰性胃癌に対する1次化学療法へのRamucirumabの上乗せ効果は、PFSにおいて25%のリスク減少をもたらしたものの、全生存期間への寄与は示されなかった。
(レポート:筑波大学附属病院 消化器内科 病院講師 山本 祥之)

監修・レポーター
監修
谷口 浩也先生
愛知県がんセンター中央病院 薬物療法部 医長
レポーター
賀川 義規先生
関西ろうさい病院 下部消化器外科 副部長
#745
監修
山﨑 健太郎先生
静岡県立静岡がんセンター 消化器内科 医長
レポーター
山本 祥之先生
筑波大学附属病院 消化器内科 病院講師
#557
監修
上野 誠先生
神奈川県立がんセンター 消化器内科 医長
レポーター
高橋 秀明先生
国立がん研究センター東病院 肝胆膵内科 医員
#207