2018年1月18日~20日に米国サンフランシスコにて開催された2018年 消化器癌シンポジウム(2018 Gastrointestinal Cancers Symposium)より、大腸癌や胃癌、肝細胞癌などの注目演題のレポートをお届けします。演題レポートの冒頭には“Expert's view”として、臨床研究の第一線で活躍する監修ドクターのコメントを掲載しています。
胃癌
胃癌腹膜播種に対する抗EpCAM-CD3バイスペシフィック抗体Catumaxomabを用いた腹腔内免疫療法の検討:無作為化比較第II相試験(AIO試験:CatuNeo)の最終報告
Intraperitoneal immunotherapy with the bispecific anti-EpCAM x anti-CD3 directed antibody catumaxomab for patients with peritoneal carcinomatosis from gastric cancer: Final results of a randomized phase II AIO trial
Florian Lordick, et al.
Expert’s view

山﨑 健太郎先生
静岡県立静岡がんセンター 消化器内科 医長
本試験において胃癌腹膜播種症例に対するFLOT療法へのCatumaxomab腹腔内投与併用の有用性は示せなかった。既報のPhase II/III試験において、腹水中EpCAM陽性の上皮癌に対するEpCAM-CD3バイスペシフィック抗体であるCatumaxomabの腹腔内投与は、腹水穿刺のみに対して有意に無腹水穿刺生存期間(HR: 0.254、p<0.0001)、腹水穿刺期間(HR: 0.169、p<0.0001)を延長させ、さらに胃癌サブグループ(n=66)においては生存期間(HR: 0.469、p=0.0313)も有意に延長させた1)。Catumaxomabの製造販売が中止されたため、本試験は予定登録数を達成する前に途中中止となったが、そもそも試験計画時の症例数設定(n=42)では検出力不足であると考える。その他、本試験の結果を評価する上で検討すべきこととしては、主要評価項目である"腹腔鏡による完全寛解"が妥当かつ客観性がある指標なのかどうか、本試験の対象は腹膜播種のみの胃/食道胃接合部腺癌患者であったが、Catumaxomab腹腔内投与の有用性を示した既報の対象は腹水中EpCAM陽性例であり対象が異なること、さらに既報とは異なりCatumaxomab腹腔内投与単独の有効性の検討ではなく、強力な全身化学療法(FLOT)への上乗せ効果を検討していることが挙げられる。いずれにせよ、同対象に対する全身化学療法へのCatumaxomab腹腔内投与併用の有用性は示せなかったが、腹膜播種EpCAM陽性例のみを対象とした検討やプロトコール治療開始後に切除を行った症例(Secondary resection rate; Catumaxomab腹腔内投与併用群 vs. 非併用群53% vs. 31%)における生存期間解析などの検討は必要であると考える。
(コメント・監修:静岡県立静岡がんセンター 消化器内科 医長 山﨑 健太郎)
腹膜播種に対するCatumaxomabの効果
CatumaxomabはIgG型のマウス・ラットハイブリッド抗体であり、細胞接着因子であるEpithelial cell adhesion molecule(EpCAM)とT細胞の表面抗原であるCD3の2つの抗原に対して結合可能なバイスペシフィック抗体である。CatumaxomabはT細胞リクルート抗体と呼ばれ、EpCAMを細胞表面に発現した癌細胞とT細胞を架橋し、CD3を介してT細胞を活性化させ、またFcγを介してADCCやCDCといった細胞傷害性の抗腫瘍効果を発揮する2,3)。これまでに、無作為化比較第II/III相試験において、標準化学療法が無効となった腹膜播種を有する卵巣癌および胃癌を含めたその他の癌種のBest supportive care(BSC)症例に対してCatumaxomabの腹腔内投与は、腹水穿刺のみと比較し有意に穿刺間隔の延長や(胃癌のコホートにおいてはOSも延長)1)、QOLの改善を示し4)、2009年にEU諸国において腹腔内治療薬として承認されている。しかしながら、全身化学療法との併用による抗腫瘍効果の検討はされておらず、本試験は腹膜播種を有する進行胃癌に対してFLOT療法との逐次投与の有効性を検討した無作為化比較第II相試験である。
主要評価項目は腹膜播種の腹腔鏡的完全寛解割合
対象は、全身化学療法や免疫療法歴を有さないECOG PS 0-1の遠隔転移が腹膜播種のみの胃/食道胃接合部腺癌患者であった。事前に審査腹腔鏡で腹膜播種が評価されGilly分類(Stage 1-4)により割付調整された。方法は、介入群はCatumaxomabの腹腔内への反復増量投与[10μg(day 0)、20μg(day 3)、50μg(day 7)、150μg(day 10)]を行った後、7日間の間隔をあけてFLOT療法[Fluorouracil c.i. 2,600mg/m2/24h(day 1)、Leucovorin 200mg/m2(day 1)、Oxaliplatin 85mg/m2(day 1)、Docetaxel 50mg/m2(day 1)、2週毎、計6コース]を逐次的に行った。対照群はFLOT療法のみを行った。プロトコール治療後に再度審査腹腔鏡(2nd look)を行い、腹膜播種の腹腔鏡的完全寛解(mCR:洗浄細胞診は行わず腹腔鏡の所見で判断)の有無を評価した。また、原発巣を含めたすべての病変がCRであった場合は胃切除や腹膜切除を行うことを許容した(図1)。
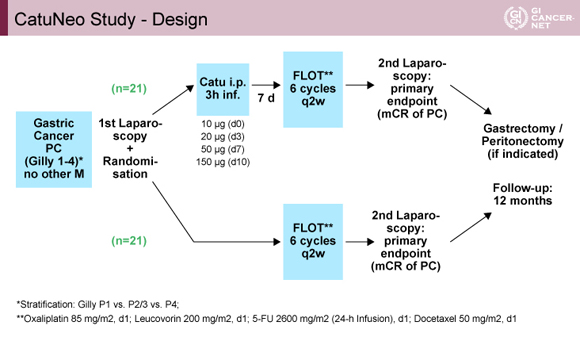
発表者の許可を得て掲載(approved by Florian Lordick)
主要評価項目は、腹膜播種のmCR割合であり、副次評価項目は、安全性、無増悪生存期間(PFS)、全生存期間(OS)であった。本試験は無作為化比較第II相試験であったが、統計学的デザインは単群第II相試験で用いられるSimon's two-stage designが用いられ、mCR割合の閾値を5%、期待値を20%として、片側α=0.1、β=0.8で計画され、必要症例数はCatumaxomab+FLOT群が21例、2群で計42例に設定された。PFSやOSの2群間の比較は、そもそも試験デザインの問題から症例数が少なく検出力不足が懸念されたが、さらに2014年のCatumaxomabの製造販売中止に伴い薬剤調達が不可能となったため、Catumaxomab+FLOT群に15例が登録された時点で試験中止となった。
Catumaxomab、FLOT療法の逐次投与の有効性は示されなかった
ドイツAIOグループの11施設から31例が登録され、Catumaxomab+FLOT群に15例、FLOT群に16例が無作為化された。患者背景のうち、年齢中央値はCatumaxomab+FLOT群56歳、FLOT群52歳、ECOG PS 0はそれぞれ50%、50%であり、TNM分類やGilly分類にも隔たりはなかったが、原発部位(胃/食道胃接合部)に関しては胃原発が93%、69%とCatumaxomab+FLOT群に多くみられた。
Catumaxomab+FLOT群15例のうち、Catumaxomab投与(計4回)を12例が完遂し、FLOT療法(計6コース)を全例が完遂した。FLOT群は15例のうち、11例が計6コースを完遂した。
主要評価項目のmCR割合は、Catumaxomab+FLOT群は27%(4/15例)と事前の期待値は達成したものの、一方のFLOT群は19%(3/16例)であり、有意差は認めなかった(p=0.69)。RECIST基準の奏効率についてはCatumaxomab+FLOT群、FLOT群ともに46%であった(表1)。
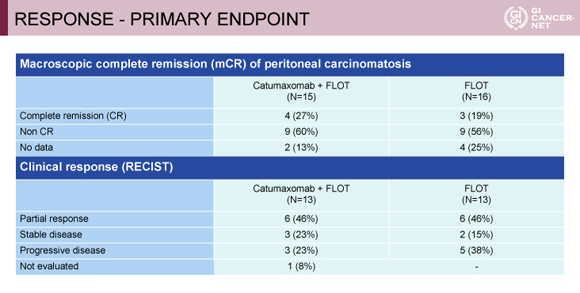
発表者の許可を得て掲載(approved by Florian Lordick)
PFSの中央値は、Catumaxomab+FLOT群6.7ヵ月、FLOT群5.4ヵ月、ハザード比は0.85(95% CI: 0.35-2.05)であり、統計学的に優越性が示されなかった(p=0.71)。同様にOSの中央値も、Catumaxomab+FLOT群13.2ヵ月、FLOT群13.0ヵ月、ハザード比は0.98(95% CI: 0.45-2.13)であり、統計学的に優越性は示されなかった(p=0.97)(図2)。
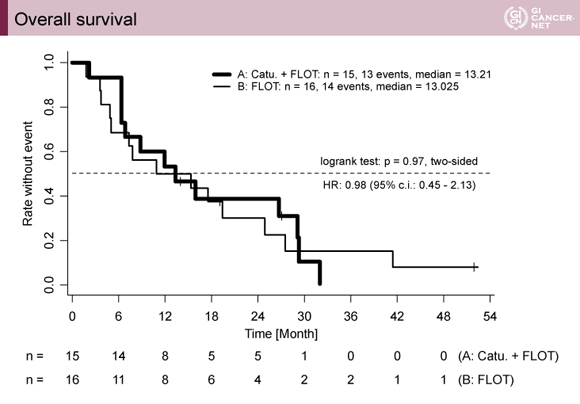
発表者の許可を得て掲載(approved by Florian Lordick)
Catumaxomab+FLOT群におけるgrade 3以上の主な有害事象のうち、Catumaxomabに関連したものは、悪心15%、発熱23%、腹痛31%、肝酵素上昇(γGTP上昇31%、ビリルビン上昇23%)であった。その他の有害事象に関してはFLOT群と同等のプロファイルであった。
まとめ
腹膜播種を有する進行胃癌に対してCatumaxomab、FLOT療法の逐次投与は忍容可能であり、腹膜播種のコントロールに有効である可能性が示唆されたが有意ではなく、生存への寄与も示されなかった。
(レポート:筑波大学附属病院 消化器内科 病院講師 山本 祥之)

監修・レポーター
監修
谷口 浩也先生
愛知県がんセンター中央病院 薬物療法部 医長
レポーター
賀川 義規先生
関西ろうさい病院 下部消化器外科 副部長
#745
監修
山﨑 健太郎先生
静岡県立静岡がんセンター 消化器内科 医長
レポーター
山本 祥之先生
筑波大学附属病院 消化器内科 病院講師
#557
監修
上野 誠先生
神奈川県立がんセンター 消化器内科 医長
レポーター
高橋 秀明先生
国立がん研究センター東病院 肝胆膵内科 医員
#207