胃癌
食道胃接合部癌
HER2過剰発現の進行または転移のある胃・食道胃接合部腺癌患者におけるHER2を標的としたペプチドワクチンHER-Vaxx(IMU-131)と標準化学療法併用の第II相試験(HERIZON)。最終OS解析
HERIZON: A phase 2 study of HER-Vaxx (IMU-131), a HER2 targeting peptide vaccine, plus standard of care chemotherapy in patients with HER2 overexpressing metastatic or advanced gastric/GEJ adenocarcinoma. Final overall survival analysis
Tanuj Chawla, et al.
Expert’s view
今回のoral abstract sessionの内、新しい結果の発表はSPOTLIGHT試験と、このHERIZON試験であった。ASCO-GIのoral presentationで、かつ、抗HER2ワクチン治療ということで、非常に期待の高い演題であった。というのも、近年mRNAワクチンを用いたがん治療の可能性が取りざたされており、モデルナのmRNAワクチンをメラノーマの術後Pembrolizumabに併用したところ、HR=0.56という驚異的な数字で再発を抑制したことがプレスリリースされたばかりである1)。コロナに対するワクチンとして急速に技術が高まったmRNAワクチンであるが、ファイザーワクチンを製造しているBioNTechとともに、mRNAによるがんワクチンの時代が開かれたと思われた。
振り返って今回のHERIZON試験である。HER2陽性胃癌の標準治療は、ToGA試験の結果、フッ化ピリミジン+プラチナ+Trastuzumabであるが、Trastuzumabが高価であり、使えない国々もあるという。今回そんな国の1つである、インドがメインの施設となり、そこに東欧の施設を加えて実施した試験である。また、HERIZON試験で用いられたがんワクチンはHER2を標的としたペプチドワクチンで、人工的に作製されたワクチンを、毎週1回皮下注を行うという方法である。標準治療はTrastuzumab併用ではなく、通常の化学療法であり、それにHER2標的ペプチドワクチンを毎週1回併用する群を比較する試験である。試験という意味では、併用群において、有意差をもって生存期間を延長し、ポジティブ試験ということになるが、いくつかの問題点がある。
まずは、標準治療がTrastuzumab併用化学療法でないところで、現在の日本や西洋の国々ではすでにToGA試験の結果、Trastuzumabを併用することで生存期間の延長(13.8ヵ月vs. 17.1ヵ月、HR=0.74)が得られ、日常診療として用いられている。今回の試験では標準治療群が8.9ヵ月、ワクチンとの併用にて13.8ヵ月であり、ワクチンの上乗せ効果があるという発表者の報告であるが、KM曲線をみるとHR=0.58もあるのか微妙であり、少なくともconclusiveな結果ではないと感じる。また、非常に数が少ないので確定的なものではないが、食欲低下や倦怠感など、毒性もペプチドワクチン群で比較的高いのも気になるところである。免疫アジュバントとして投与されるMontanideに対する反応による可能性があるが、皮下注を毎週腋窩に行う必要があるなど、比較的患者負担の多い治療であることを考えると、益と害のバランスが適切か、判断が必要である。また、今回はTrastuzumabとの直接比較ではないため、すでにTrastuzumabが標準治療とされている国では、メリットが何かわかりにくい。
いろいろな疑問点があるが、今回の発表では、今まで直接抗体薬を用いていたものに対し、抗原を導入し自前の抗体を産生させ、それが抗腫瘍効果を発揮する可能性を示したという点では、貴重な発表と考える。今後は、ペプチドワクチンではなく、mRNAワクチンを用いるなど、より進化した治療として開発される可能性を感じさせた発表であった。
(コメント・監修:国立がん研究センター中央病院 消化管内科/頭頸部・食道内科 科長 加藤 健)
切除不能進行HER2陽性胃および食道胃接合部癌に対する治療開発とHER2ペプチドワクチン
本邦におけるHER2陽性胃および食道胃接合部癌に対する一次治療は、フッ化ピリミジン系薬剤およびプラチナ系薬剤、Trastuzumabの併用療法が標準治療となっている(ToGA試験)2)。KEYNOTE-811試験は、HER2陽性胃および食道胃接合部癌に対する一次治療として、標準治療である5-FU+CDDPあるいはCapeOx+Trastuzumabに、Pembrolizumabとプラセボを無作為に併用した比較試験であり、予定された中間解析では、主要評価項目である奏効割合(ORR)が試験治療群で優越性を示した3)。この結果から、米国食品医薬品局(FDA)は、同対象に対してPembrolizumabとTrastuzumabのフッ化ピリミジン系薬剤およびプラチナ系薬剤を含む化学療法との併用を迅速承認した。ただし同試験は、最終的な主要評価項目である無増悪生存期間(PFS)と全生存期間(OS)の結果が出ていないため、いまだ本邦では承認されていない。また本邦は同対象に対し、S-1/Capecitabine+Oxaliplatin+Trastuzumab+Nivolumab併用療法による臨床試験(Ni-HIGH試験)4)も行われており、近い将来本邦でもフッ化ピリミジン+プラチナ+Trastuzumab+免疫チェックポイント阻害薬がHER2陽性胃および食道胃接合部癌における一次治療となることが予想される。
今回これまでとは異なる作用をもったBリンパ球刺激がんペプチドワクチンであるHER2ペプチドワクチンIMU-131を用いた無作為化比較試験が行われた。IMU-131は、HER2タンパクの細胞外ドメインである3つのペプチド(P4、P6、P7)から構成されている。またこのB細胞ワクチンは、TrastuzumabのようなHER2モノクローナル抗体特有の有害事象を回避する一方で、同様の有効性が期待されている5,6)。
化学療法単独に対するHER2ペプチドワクチンIMU-131+化学療法併用の優越性を検証
対象は抗HER2抗体未治療例である切除不能進行HER2陽性胃および食道胃接合部癌で、東欧とインドから症例登録された(図1)。またIMU-131に標準化学療法を併用する群と、標準化学療法を単独で行う群に無作為に割り付けられた。IMU-131+化学療法併用群では、IMU-131 50μgを1、15、36、78日目に投与し、その後63日ごとに病勢進行(PD)までIMU-131を投与した。化学療法は、両群とも初日から21日おきに最大6サイクルまで投与された。治療はPDまたは中止まで継続された。化学療法は、Cisplatin+5-FUまたはCapecitabine、あるいはOxaliplatin+Capecitabineが投与された。主要評価項目はOSで、事前に規定された片側αは0.10、検出力は90%であった。
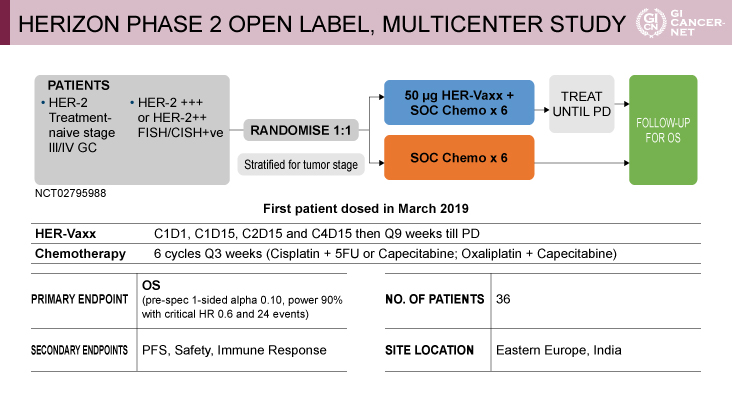
発表者の許可を得て掲載(approved by Tanuj Chawla)
HER2ペプチドワクチンIMU-131+化学療法併用群は化学療法単独群に対してOSを有意に改善した
無作為化された36例の患者は、IMU-131+化学療法併用群に19例、化学療法単独群に17例が割り付けられ(それぞれ4例[21%]と2例[12%]に前治療歴あり)、それぞれ15例と17例に生存イベントが発生した。解析の結果、IMU-131+化学療法併用群は化学療法単独群に対してOSを有意に改善した(ハザード比[HR]=0.580(80%両側信頼区間[CI]:0.362-0.927、p=0.066)(図2)。OSの中央値は、IMU-131+化学療法群が13.9ヵ月(7.5-14.3ヵ月)、化学療法単独群が8.3ヵ月(6.0-9.6ヵ月)であった。PFSの中央値はIMU-131+化学療法群が6.93ヵ月(5.6-9.9ヵ月)、化学療法単独群が6.02ヵ月(2.2-8.3ヵ月)であった。奏効期間の中央値は、IMU-131+化学療法併用群が30週、化学療法単独群が19週であった。有害事象に関しては、食欲不振がIMU-131+化学療法群で26%、化学療法単独群で6%、頭痛がIMU-131+化学療法群で26%、化学療法群で0%、インフュージョンリアクションがIMU-131+化学療法群で11%であり、両群に大きな違いはみられなかった(表1)。またIMU-131+化学療法群に明らかな心毒性はみられなかった。
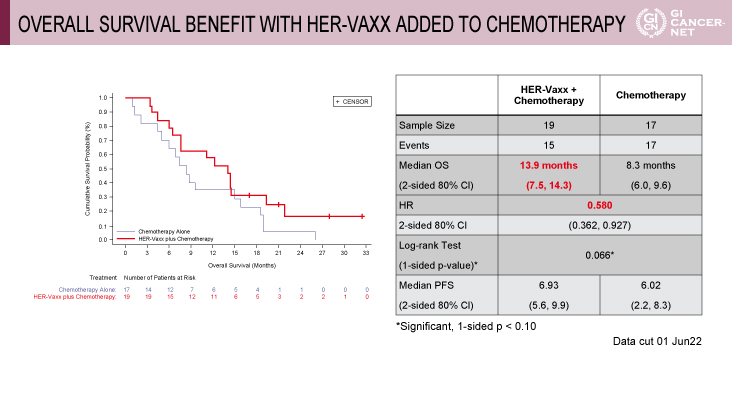
発表者の許可を得て掲載(approved by Tanuj Chawla)
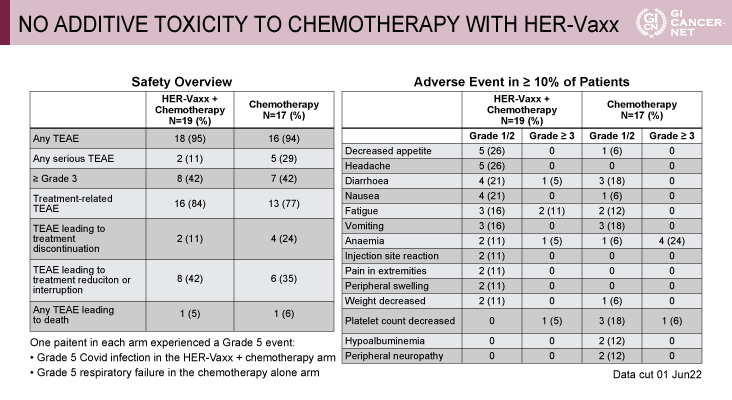
発表者の許可を得て掲載(approved by Tanuj Chawla)
まとめ
抗HER2抗体未治療の切除不能進行HER2陽性胃および食道胃接合部癌における、化学療法単独群に対するIMU-131+化学療法併用群のOSの優越性が示された。有害事象に関しては、両群間において明らかな差は認めず、IMU-131+化学療法群においては抗HER2抗体薬に特異的な有害事象を回避できる可能性が示唆された。Paclitaxel+RamucirumabやPembrolizumabとの併用療法の試験も進行中であり、今後の展開が期待される(NCT05311176)。
(レポート:国立がん研究センター中央病院 消化管内科 池田 剛)
References
- 1) https://www.merck.com/news/moderna-and-merck-announce-mrna-4157-v940-an-investigational-personalized-mrna-cancer-vaccine-in-combination-with-keytruda-pembrolizumab-met-primary-efficacy-endpoint-in-phase-2b-keynote-94/
- 2) Bang YJ, et al.: Lancet. 376(9742): 687-697, 2010 [PubMed]
- 3) Janjigian YY, et al.: Nature. 600(7890): 727-730, 2021 [PubMed]
- 4) Takahari D, et al.: J Clin Oncol. 38(15_suppl): 4525-4525, 2020 [JCO]
- 5) Wiedermann U, et al.: Clin Cancer Res. 27(13): 3649-3660, 2021 [PubMed]
- 6) Laeufle R, et al.: J Clin Oncol. 39(15_suppl): e16065, 2021 [JCO]
関連サイト
- ・HERIZON試験 [ClinicalTrials.gov]
- ・nextHERIZON試験 [ClinicalTrials.gov]
- ・ToGA試験 [論文紹介]
- ・KEYNOTE-811試験 [論文紹介]
- ・Ni-HIGH試験 [UMIN-CTR]










加藤 健先生
国立がん研究センター中央病院 消化管内科/頭頸部・食道内科 科長