胃癌
食道胃接合部癌
難治性進行胃癌・食道胃接合部癌(AGOG)においてRegorafenibとプラセボを比較した無作為化二重盲検第III相試験:INTEGRATE IIa
INTEGRATE IIa: Randomised double-blind phase III study of regorafenib versus placebo in refractory advanced gastro-oesophageal cancer (AGOC)
Nick Pavlakis, et al.
Expert’s view
胃癌のいわゆるsalvage lineにおいて、マルチキナーゼ阻害剤であるRegorafenibと、プラセボを2:1の割合で比較した国際共同医師主導治験である。消化器癌を長くやっている方であれば、大腸癌で同様のデザインで行われたCORRECT試験1)を思い起こすことであろう。Primary endpointである全生存期間において、中央値6.4ヵ月vs. 5.0ヵ月(HR=0.77、p=0.0052)と有意差を示したこの試験の結果で、大腸癌の3rd lineにおいて、Trifluridine/Tipiracilとともに、Regorafenibは標準治療の一つとなっている。
さて、同様の効果を胃癌においても示すことができるのか? 前治療において用いられた血管新生阻害剤であるRamucirumabや、免疫チェックポイント阻害剤であるNivolumabの影響はあるのか? などの細かい興味も、INTEGRATE試験には向けられていた。結果は、全生存期間において、rPIIであったIとIII相であるIIb試験を合わせた303例において、有意に生存期間を延長した(HR=0.70、p=0.001)。PFSについても同様に延長効果を示しており、大腸癌で示された結果が胃癌でも再現されたといえる。中央値で比較すると、OSは0.5ヵ月、PFSは0.2ヵ月と少ないが、その後に差が広がっており、曲線全体をみると、しっかりと離れており、臨床的には有意な差と思われる。有害事象については、Regorafenibに多く認められる倦怠感や、手足症候群、肝障害、高血圧が報告されているが、既報と変わらず、コントロール可能と思われる。また、HRQoLも、Regorafenib群で良好であり、有害事象があっても、それ以上に癌を抑えることで、HRQoLの改善があったということを示している。この結果によりRegorafenibも胃癌の後方ラインの治療の一つとして承認され、新たな選択肢として加わると思われる。
懸念点としては、一般診療における、毒性のマネジメントである。大腸癌においても、臨床試験で行われた160mgで開始して継続できる患者さんはほぼおらず、現在80~120mgで開始し、毒性をみながら少しずつ上げていくというような手法で投与されている。治療効果、毒性ともに大腸癌とほぼ同様と考えると、より状態の悪い胃癌のlate lineの患者さんにおいては、より一層の患者選択と慎重な投与が求められると考えられる。
いずれにしてもポジティブな結果かつ、practical changingな結果であり、この成果を成し遂げた研究者にはおめでとうと言いたい。
(コメント・監修:国立がん研究センター中央病院 消化管内科/頭頸部・食道内科 科長 加藤 健)
進行胃癌に対するRegorafenibの開発
切除不能再発・遠隔転移進行胃癌に対する治療選択肢は限られている2)。Regorafenibは経口マルチキナーゼ阻害薬であり、無作為化第II相試験であるINTEGRATE試験において、すべてのサブグループでプラセボ群と比較しRegorafenib群は無増悪生存期間(PFS)の延長を認めた3)。INTEGRATE II試験は少なくとも2ライン以上の治療を受けた患者を対象に、Regorafenibの有効性を検証した第III相試験である。
2019年の12月にINTEGRATE II試験はプロトコールが修正され、Regorafenibとプラセボを比較するINTEGRATE IIaとRegorafenib+Nivolumabと化学療法を比較するINTEGRATE IIbに分けられた。今回、INTEGRATE試験とINTEGRATE IIa試験のプール解析の結果が報告された。
プラセボに対するRegorafenibの優越性を検証
本試験は多施設、無作為化比較第III相試験である。主な適格基準として①18歳以上、②Eastern Cooperative Oncology Group Performance Status(ECOG PS)が0または1、③組織学的または細胞学的に進行胃・食道胃接合部癌と証明されている、④プラチナ製剤とフッ化ピリミジン系薬剤を含む2ライン以上の治療歴があることが挙げられた(図1)。患者はRegorafenib群とプラセボ群に2:1に無作為化され、原発部位(食道胃接合部vs. 胃)、地域(アジアvs. それ以外)、VEGF阻害薬の使用歴(ありvs. なし)で層別化された。Regorafenib群は1日1回160mg(40mg 4錠)をday 1からday 21、28日毎に病勢進行または許容できない毒性まで継続された。主要評価項目はintention to treat(ITT)集団における全生存期間(OS)で、副次評価項目はPFS、客観的奏効割合、QOL評価(EORTC QLQ-C30、STO22)、安全性(CTCAE v4.03)、薬物動態、バイオマーカーであった。検出力80%、両側α5%、標準治療に対しOSのハザード比(HR)=0.67とし、221イベントが必要とされた。
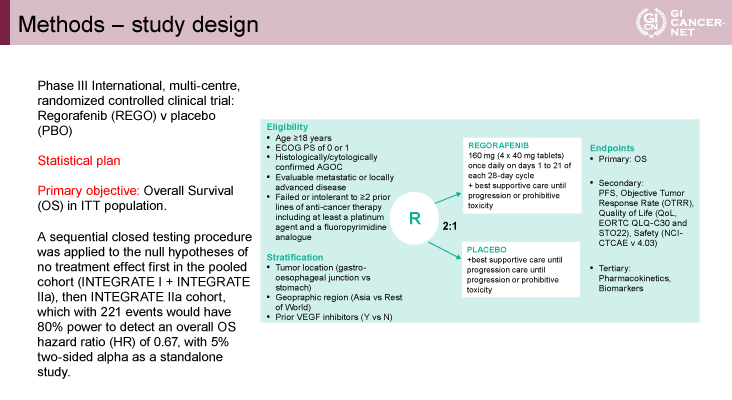
発表者の許可を得て掲載(approved by Nick Pavlakis)
プラセボに対するRegorafenibのOSの優越性が示された
2016年10月から2021年9月までに、6ヵ国から251例の患者が無作為化された。251例のうち157例がアジア(韓国、台湾、日本)から、94例がオーストラリア、ニュージーランド、カナダから登録され、169例がRegorafenib群に、82例がプラセボ群に登録された。患者背景は両群で偏りはみられなかった(表1)。
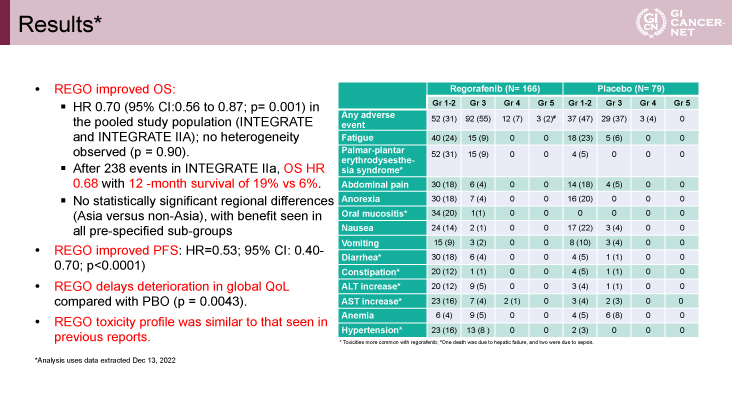
主要評価項目であるOSは有意にRegorafenib群で良好であった[HR=0.70(95% CI: 0.56-0.87)、p=0.001](図2)。238イベント時点で、OSのHR=0.68で12ヵ月生存割合はRegorafenib群で19%、プラセボ群で6%であった。事前に設定したサブループでは一貫してRegorafenib群が良好であった。副次評価項目であるPFSについてもRegorafenib群が有意に良好であった[HR=0.53(95% CI: 0.40-0.70)、p<0.0001](図3)。Regorafenib群はプラセボ群と比較し、QOL低下までの期間が延長した(p=0.0043)。Regorafenibの毒性は以前の報告と同様であった(表2)。
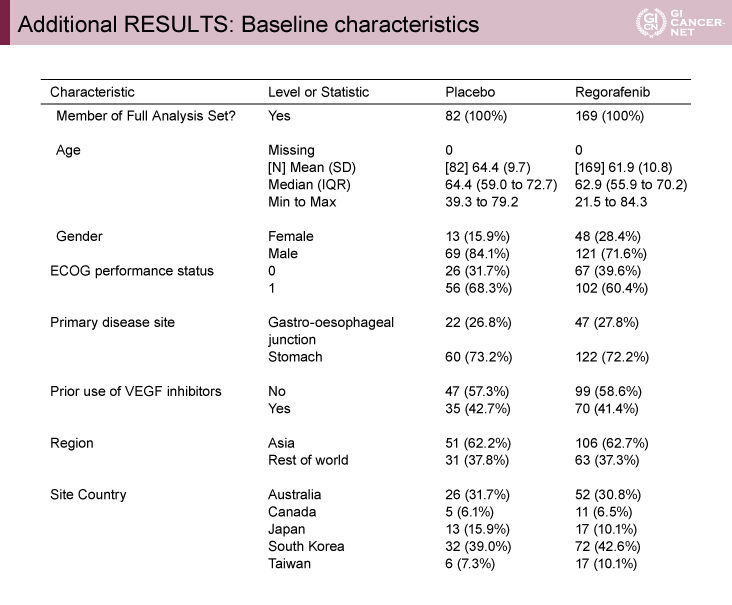
発表者の許可を得て掲載(approved by Nick Pavlakis)
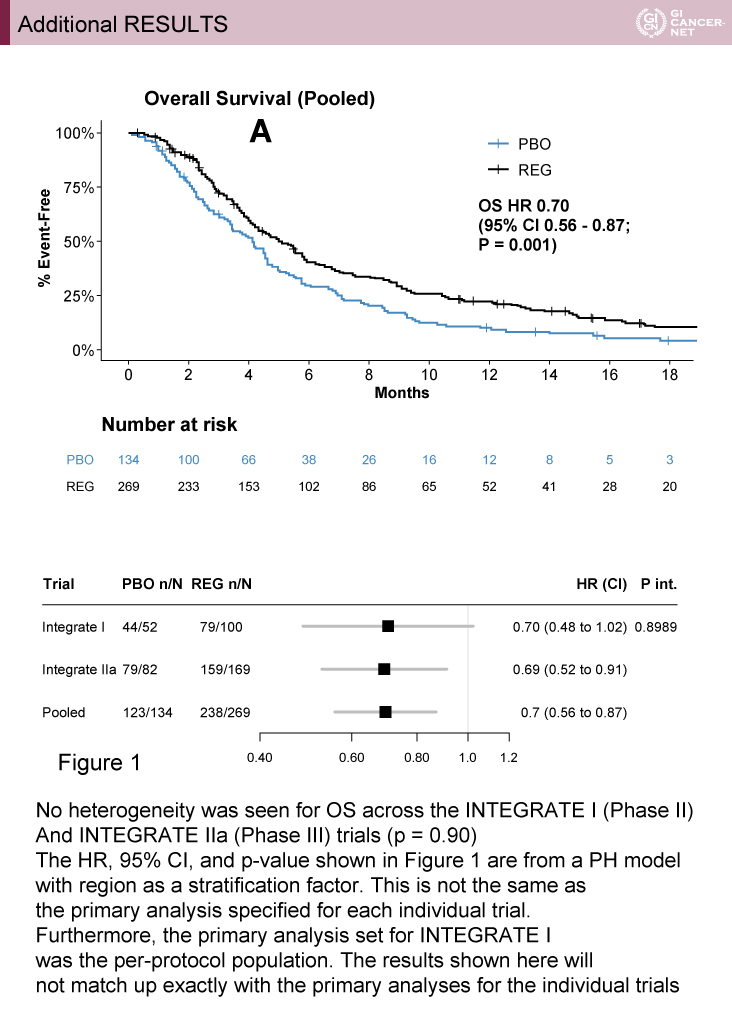
発表者の許可を得て掲載(approved by Nick Pavlakis)
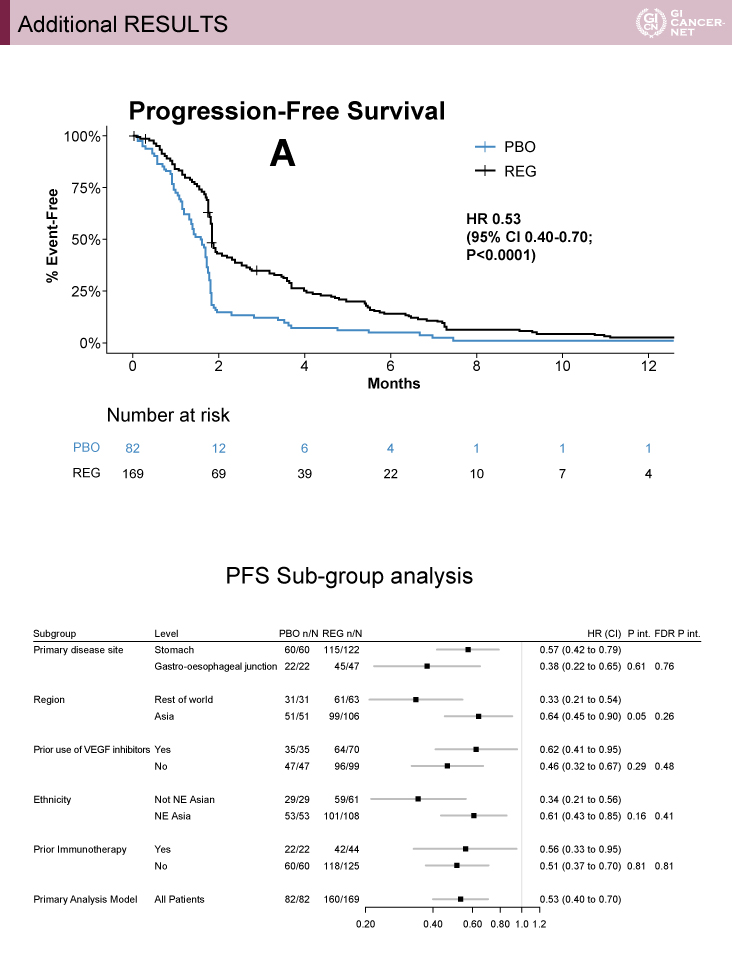
発表者の許可を得て掲載(approved by Nick Pavlakis)
発表者の許可を得て掲載(approved by Nick Pavlakis)
まとめ
切除不能再発・遠隔転移進行胃癌に対するRegorafenibはプラセボと比較し有意に生存期間の延長、QOL低下までの期間の延長を示し、新規の有害事象は認められなかった。事前に設定されたすべてのサブグループで有効性を示し、新規治療選択肢として挙げられる。
(レポート:国立がん研究センター中央病院 消化管内科 角埜 徹)
References
- 1) Grothey A, et al.: Lancet. 381(9863): 303-312, 2013 [PubMed]
- 2) Smyth EC, et al.: Lancet. 396(10251): 635-648, 2020 [PubMed]
- 3) Pavlakis N, et al.: J Clin Oncol. 34(23): 2728-2735, 2016 [PubMed]
関連サイト
- ・INTEGRATE IIa試験 [ClinicalTrials.gov]
- ・INTEGRATE IIb試験 [ClinicalTrials.gov]
- ・CORRECT試験 [ClinicalTrials.gov] [座談会] [論文紹介]










加藤 健先生
国立がん研究センター中央病院 消化管内科/頭頸部・食道内科 科長