胃癌
食道胃接合部癌
Claudin18.2陽性/HER2陰性の切除不能進行胃癌・食道胃接合部癌に対する1次治療のZolbetuximab+mFOLFOX6療法(SPOTLIGHT試験)
Zolbetuximab + mFOLFOX6 as 1L treatment for patients with CLDN18.2+/HER2- locally advanced (LA) unresectable or metastatic gastric or gastroesophageal junction (mG/GEJ) adenocarcinoma: Primary phase 3 results from SPOTLIGHT
Kohei Shitara, et al.
Expert’s view
新しいバイオマーカーと新しい標準治療
胃癌の1次治療において化学療法にZolbetuximabの上乗せ効果を検証した2つの第III相試験の結果がpositiveであったことがすでにプレスリリースされ、CLDN18.2陽性胃癌の新しい標準治療ができることに世界が注目していた。今回はその2つの試験のうちのひとつ、SPOTLIGHT試験の結果報告であり、学会1日目で最も注目された演題だったといえるだろう。主要評価項目のOSおよびPFSが有意に延長しており、1次治療から予後延長が見込める治療であることが確認された。奏効率はプラセボ群と差がなく、まさに腫瘍抑制効果を有する薬剤であることが想像される。
本邦の後方視研究において、CLDN18.2陽性は切除不能胃癌の24%に認められるが1)、他のバイオマーカーとオーバーラップする症例においては、Zolbetuximabが承認された場合、1次治療の治療選択についてさらなる議論が必要と考えられる。特に、CPS≧5を認める症例においては、免疫療法を先に行うべきか、Zolbetuximabを先に行うべきか、重要なクリニカルクエスチョンになるであろう。学会のディスカッションパートでは、Zolbetuximabの承認条件によるところもあるが、免疫チェックポイント阻害薬は1次治療および後治療で使用することが可能な状況(本邦)であるため、1次治療でのみ使用できる場合はCLDN18.2に対する治療が優先されるべきという議論が行われていた。
CLDN18.2は、胃癌のほか食道癌や膵癌、非小細胞肺癌などでも異所性に発現することがわかっており、今回の結果を受けて他癌種での治療開発が進むことも予想される。さらに、CLDN18.2を標的とした治療薬は、Zolbetuximabのようなモノクローナル抗体のほか、ADC製剤やCAR-T(キメラ抗原受容体T細胞)療法、Bite(二重特性T細胞誘導抗体)製剤なども開発中であり、今後CLDN18.2を標的とした治療開発がさらに加速することが予想される。
(コメント・監修:聖マリアンナ医科大学 臨床腫瘍学 主任教授 砂川 優)
背景:Claudin18.2を標的としたZolbetuximabについて
Claudin18.2(以下、CLDN18.2)は、タイトジャンクションを構成する膜タンパク質の1つである。正常組織では胃に特異的に発現しており、胃癌においても多くはその発現が保たれるが、悪性転化の過程でCLDN18.2は癌細胞の外側に露出し、良い治療ターゲットになると考えられた2)。このような特徴から、CLDN18.2を標的としたキメラ化IgG1モノクローナル抗体であるZolbetuximabが開発された。Zolbetuximabは、腫瘍細胞表面上のCLDN18.2に結合し細胞性および可溶性免疫エフェクターを刺激して抗体依存性細胞障害(ADCC)活性、補体依存性細胞障害(CDC)活性を誘導して抗腫瘍効果を示すとされている。第IIb相試験であるFAST試験では、欧州における胃癌の標準治療の1つであるEOX療法(Epirubicin、Oxaliplatin、Capecitabine)に対するZolbetuximabの上乗せ効果が示され、サブグループ解析では特にCLDN18.2高発現の集団において比較的高い効果が示された3)。この結果から、CLDN18.2高発現の胃癌・食道胃接合部癌を対象とした第III相試験であるSPOTLIGHT試験が実施された。
SPOTLIGHT試験の対象と方法
SPOTLIGHT試験は、未治療の切除不能な局所進行もしくは転移性の胃癌・食道胃接合部癌(腺癌)を対象とした国際共同二重盲検無作為化第III相試験である。主な適格基準はCLDN18.2陽性(免疫組織化学染色で中等度~強度の染色が75%以上の腫瘍細胞にみられる)、HER2陰性、ECOG PS 0-1であり、層別化因子は地域(アジアvs. アジア以外)、転移臓器個数(0-2 vs. ≧3)、胃切除術(ありvs. なし)であった。適格患者は、1:1で試験治療群のZolbetuximab(初回800mg/m2、2回目以降600mg/m2、3週毎)+化学療法(mFOLFOX6、2週間毎)と対照群のプラセボ(3週間毎)+化学療法(mFOLFOX6、2週間毎)に割り付けされた。主要評価項目は無増悪生存期間(PFS: progression-free survival)であり、副次評価項目に全生存期間(OS: overall survival)を含む(図1)。PFSにおいて統計学的優越性が示された場合にのみ、OSの統計学的検定を行う手順で試験が実施された。
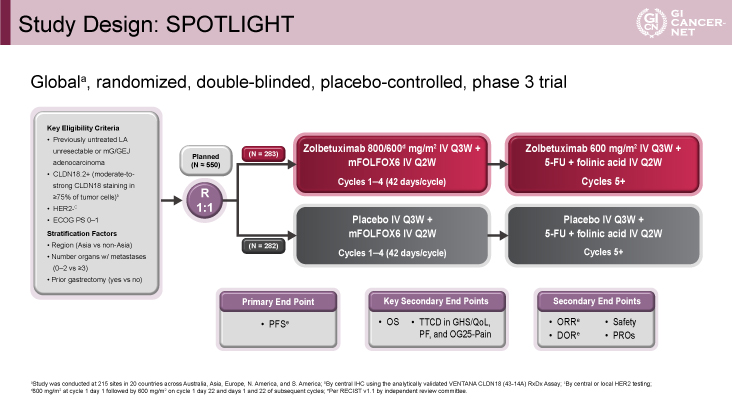
発表者の許可を得て掲載(approved by Kohei Shitara)
PFS(主要評価項目)およびOS(副次評価項目)いずれにおいてもZolbetuximabの上乗せ効果が示される
スクリーニング検査を受けた計2,735例のうち、計565例が1:1で各々の治療群に無作為に割り付けされた。両群において患者背景の偏りはなかった。約3割がアジア人で、胃切除歴のある患者が約3割、胃原発が約7割であった(表1)。
PFS中央値(Zolbetuximab併用群vs. 対照群)は各々10.61ヵ月、8.67ヵ月であり、Zolbetuximab併用群で有意に延長した(ハザード比[HR: hazard ratio]=0.751、95%信頼区間[CI: confidence interval]: 0.589-0.942、p=0.0066)(図2)。PFSで統計学的優越性が示されたため、OSの統計学的解析が施行されているが、OS中央値は各々18.23ヵ月、15.54ヵ月であり、こちらも有意にZolbetuximab併用群で延長した(HR=0.750、95% CI: 0.601-0.936、p=0.0053)(図3)。中央判定による客観的奏効率は、Zolbetuximab併用群で60.7%、化学療法群で62.1%であり概ね同等であった。奏効期間は、中央値は各々8.51ヵ月、8.11ヵ月であったが、第三四分位数(※最小から数えて3/4の位置にある数値)は、各々29.9ヵ月、15.5ヵ月であり、Zolbetuximab併用群でより持続的効果が得られやすいことが示唆された。また、PFSやOSのサブグループ解析では、いずれのサブグループにおいても一貫した上乗せ効果がみられることが示された。
Grade 3以上の有害事象は各々86.7%、77.7%と同程度であった。このうち悪心(16.1% vs. 6.5%)、嘔吐(16.1% vs. 5.8%)はZolbetuximab併用群で約10%多かった(図4)。しかしながら、Zolbetuximab併用群における悪心・嘔吐はZolbetuximab投与の1~2サイクル目の投与時に多く、ほとんどは投与速度の調整で管理可能であり、それ以降のサイクルではそれらの有害事象の頻度が減ることも同時に示された。
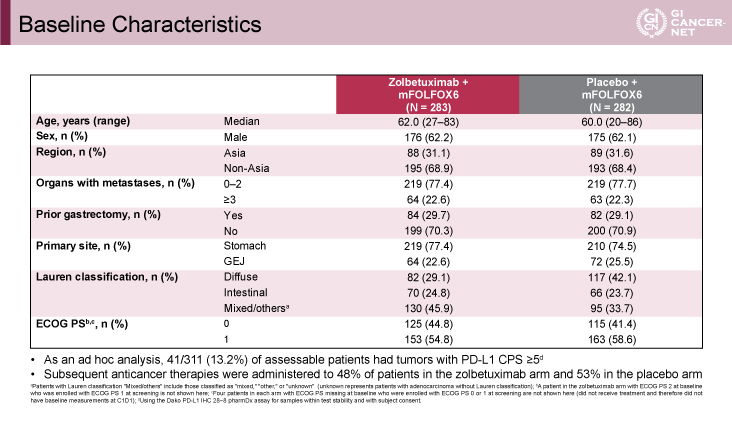
発表者の許可を得て掲載(approved by Kohei Shitara)
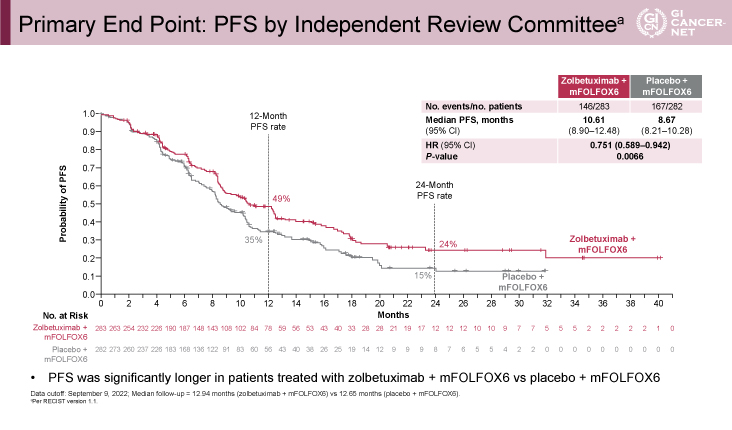
発表者の許可を得て掲載(approved by Kohei Shitara)
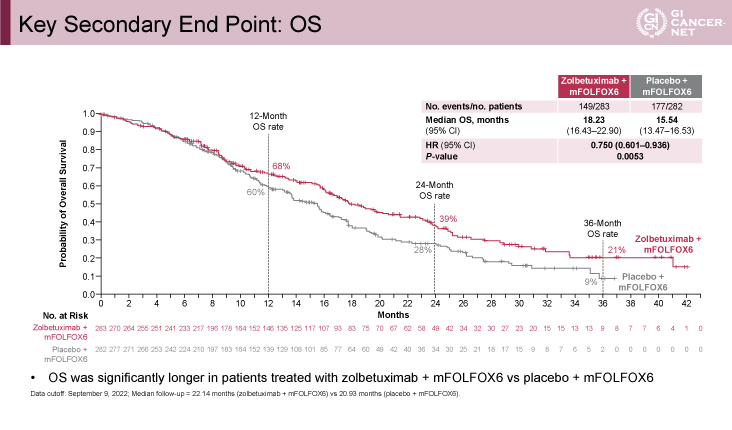
発表者の許可を得て掲載(approved by Kohei Shitara)
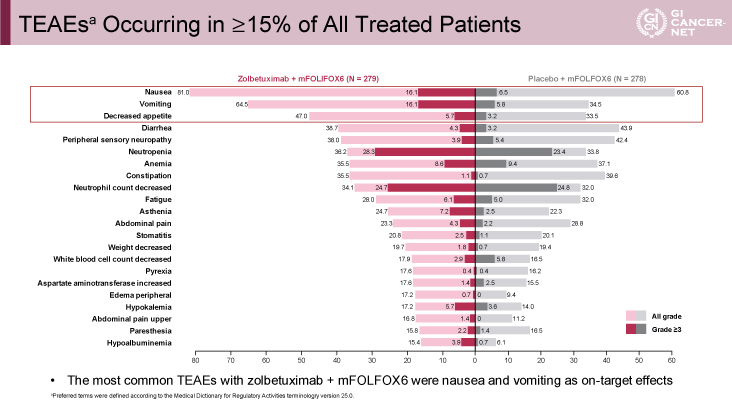
発表者の許可を得て掲載(approved by Kohei Shitara)
まとめ
CLDN18.2陽性/HER2陰性の切除不能進行胃癌・食道胃接合部癌に対するZolbetuximabのPFSおよびOSの延長効果がいずれも有意に示され、有害事象に関しても許容範囲・管理可能であった。Zolbetuximabは、胃癌においてTrastuzumab以降、1次治療で有意に予後延長効果を認めた唯一のモノクローナル抗体となり、今後CLDN18.2陽性胃癌に対する標準治療薬の1つとなることが期待される。
(レポート:聖マリアンナ医科大学 臨床腫瘍学 久保田 洋平)
References
- 1) Kubota Y, et al.: ESMO Open. 8(1): 100762, 2023 [PubMed]
- 2) Kyuno D, et al.: Tissue Barriers. 10(1): 1967080, 2022 [PubMed]
- 3) Sahin U, et al.: Ann Oncol. 32(5): 609-619, 2021 [PubMed]
関連サイト
- ・SPOTLIGHT試験 [ClinicalTrials.gov]
- ・FAST試験 [ClinicalTrials.gov] [論文紹介]










砂川 優先生
聖マリアンナ医科大学 臨床腫瘍学 主任教授