膵癌
遠隔転移を有する膵癌に対するNALIRIFOX療法の第III相試験(NAPOLI-3試験)
NAPOLI 3: A randomized, open-label phase 3 study of liposomal irinotecan + 5-fluorouracil/leucovorin + oxaliplatin (NALIRIFOX) versus nab-paclitaxel + gemcitabine in treatment-naïve patients with metastatic pancreatic ductal adenocarcinoma
Zev A. Wainberg, et al.
Expert’s view
今回のASCO-GIにおいて肝胆膵領域ではもっとも注目された演題であったと考える。
本試験は化学療法未治療の遠隔転移を有する膵癌患者を対象とし、NALIRIFOX療法の有効性および安全性をGnP療法と比較する海外第III相試験であった。主要評価項目に設定されたOSのHRは0.83、中央値はNALIRIFOX療法群11.1ヵ月、GnP療法群9.2ヵ月と統計学的有意にNALIRIFOX療法群で良好であった。また、副次評価項目に設定されたPFS、奏効割合はいずれもNALIRIFOX療法群で良好であった。以上より、NALIRIFOX療法は当該患者に対する1次薬物療法として標準治療に位置づけられると結論づけられた。
現在、本邦を含む世界的に化学療法未治療の進行・再発膵癌患者に対する標準治療としてFOLFIRINOX療法とGnP療法の2つが存在する状態であり、それらを比較する臨床試験が本邦でも実施中である。NALIRIFOX療法はFOLFIRINOX療法のIrinotecanをナノリポソーム型Irinotecan(Nal-IRI)に置換したものであるが、現在用いられているNal-IRI+5-FU/LV療法やFOLFIRINOX療法と比較して本試験のNALIRIFOX療法ではNal-IRIおよびOxaliplatinの用量が減量されていた。FOLFIRINOX療法の有用性を示した第III相試験(ACCORD 11試験)との単純比較は当然できないが、本試験で示されたNALIRIFOX療法の有効性はACCORD 11試験と同等であった一方、grade 3以上の血液毒性の頻度は大きく低下している。
FOLFIRINOX療法とGnP療法が日常診療に導入されて以降、これらを超える治療法が見出せておらず、これが初めての報告である。残念ながら本試験には日本人患者が含まれていなかったことから、FOLFIRINOX療法やGnP療法が導入された際と同様、本邦における承認には何らかのbridging studyが必要となる。本邦では遠隔転移を伴う膵癌の1次治療としてGnP療法が広く用いられており、より有効性が高い治療を選択肢に加えることができるようになることを期待したい。
(コメント・監修:金沢大学先進予防医学研究センター 特任准教授 寺島 健志)
遠隔転移を有する膵癌の1次化学療法の変遷とFOLFIRINOX系レジメンおよびLiposomal Irinotecan(Nal-IRI)への期待
遠隔転移を有する膵癌に対する化学療法レジメンとしては、かつて標準治療であったGemcitabine(GEM)単剤療法にFOLFIRINOX療法がPRODIGE 4/ACCORD 11試験で1)、GEM+Nab-Paclitaxel療法(GnP療法)がMPACT試験で2)、それぞれOSにおける優越性を示したことから国内外のガイドラインで推奨される標準レジメンに位置付けられているものの、両者の優劣や使い分けは明らかとなっていない。異なる試験間のため直接的な比較は困難であるが、有効性の面ではGEM単剤療法に対するOSのハザード比がFOLFIRINOX療法では0.57、GnP療法では0.72のため、数字上はFOLFIRINOX療法が有効である可能性が残っていた。一方で、FOLFIRINOX療法は75歳以下の比較的若年者に限定して開発が行われてきたこと、grade 3以上の好中球減少(46%)、発熱性好中球減少症(5%)、嘔吐(15%)、下痢(13%)など血液毒性や消化器毒性も高頻度であることから、相対的によりtoxicなレジメンと評価されてきた。
Nal-IRIはIrinotecanをリポソーム化したDDS製剤で、腫瘍組織局所での活性代謝物の濃度上昇による有効性の向上を狙っている。遠隔転移を有する膵癌に対しては、GEMを含む化学療法後に増悪した患者における2次化学療法以降として、5-FU/LV療法に対するOSにおける優越性がNAPOLI-1試験によって示されたため3)、この対象に対しNal-IRI+5-FU/LV療法が標準治療となっていた。これらのことから、FOLFIRINOX療法のIrinotecanをNal-IRIに置換したNALIRIFOX療法は現状の薬剤の組み合わせとしては最大の有効性をもつ可能性があり注目された。
NALIRIFOX療法については既に第I/II相試験が行われており、最大耐用量としてNal-IRI 50mg/m2(Nal-IRI+5-FU/LV療法では70mg/m2)、Oxaliplatin 60mg/m2(FOLFIRINOX療法では85mg/m2)が決定され、探索的な有効性の結果も良好であったと報告されていた4)。以上の背景から、NALIRIFOX療法のOSにおける有効性を検証するためにGnP療法と比較する第III相試験であるNAPOLI-3試験が実施された。
GnP療法に対するOSにおける優越性を検証した第III相試験
本試験のデザインは通常のOSを主要評価項目とした1:1割付の第III相試験であった。PSは0または1に限定されていたが、年齢上限は設けられていなかった。層別化因子としては、PS、地域、肝転移有無が採用されていた。NALIRIFOX療法の用量はNal-IRI 50mg/m2、Oxaliplatin 60mg/m2、LV 400mg/m2、5-FU 2,400mg/m2であり、GnP療法はMPACT試験の通常量が用いられた。8週間ごとの画像評価が行われ、副次評価項目として無増悪生存期間(PFS)、奏効割合(ORR)および安全性が設定されていた。探索的評価項目としてQOLおよびバイオマーカー解析が含まれている。参加地域は北米および欧州が中心で、アジアからは韓国が参加していたが本邦は含まれていなかった。
OSにおける優越性が示されたがリスクベネフィットバランスや通常FOLFIRINOX療法との関係、日本人への適応可能性についてどのように評価するか
ITT解析集団はNALIRIFOX療法群383例、GnP療法群387例の計770例であった。地域は北米が約31%、欧州を中心とするその他の地域が約66%であり、アジアはわずか約3%であった。年齢中央値はNALIRIFOX療法群/GnP療法群、それぞれ64歳/65歳であったが、最高齢はそれぞれ85歳/82歳まで含まれていた。2次治療移行割合は両群とも約50%であった。
主要評価項目であるOSは中央値がNALIRIFOX療法群vs. GnP療法群で11.1ヵ月vs. 9.2ヵ月(HR=0.83、95% CI: 0.70-0.99、p=0.04)であり、統計学的にNALIRIFOX療法群の優越性が検証された結果であった(図)。これは特定のサブグループでの逆転はみられず一貫した結果であった。副次評価項目のPFSは7.4ヵ月vs. 5.6ヵ月(HR=0.69、95% CI: 0.58-0.83、p<0.0001)、ORRは41.8% vs. 36.2%であった。
Grade 3以上の有害事象は全体の割合として両群に差はないものの、下痢(約20% vs. 約5%)、悪心(約12% vs. 約3%)などの消化器毒性はNALIRIFOX療法群で多く、逆に好中球減少(約10% vs. 約14%)はGnP療法群で多く、発熱性好中球減少症(両群約2%)は差がないといった分布であった(表)。
以上の結果から、発表者らはNALIRIFOX療法が遠隔転移を有する膵癌の1次化学療法として新たなリファレンスになると結論づけており、ディスカッサントも“Fit”な患者では標準治療になり得るとしていた。本邦への導入を見越したこれらの解釈には、OSの差がHR=0.83と比較的小さかった一方で臨床的に問題となる非血液毒性は高頻度であったこと、過去対象の通常FOLFIRINOX療法と数字上はOS中央値が相似していること、アジア人の割合が少なかったこと、などには注意を払う必要があると考えられる。
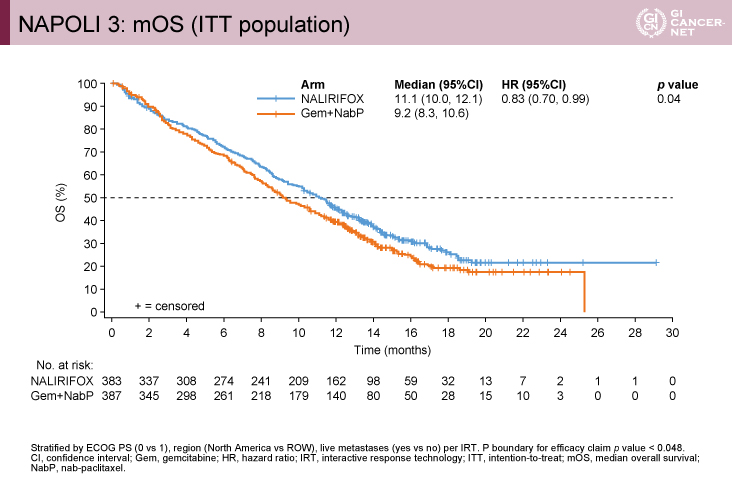
発表者の許可を得て掲載(approved by Zev A. Wainberg)
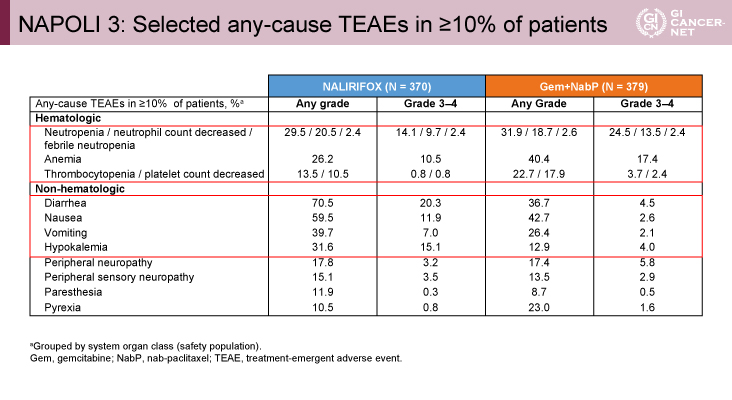
発表者の許可を得て掲載(approved by Zev A. Wainberg)
まとめ
OSにおけるNALIRIFOX療法群のGnP療法に対する優越性が検証された。全身状態が良好な遠隔転移を有する膵癌に対しては、今後、国際的にはGnP療法よりもNALIRIFOX療法が優先されるものと考えられる。一方で、毒性の観点から全身状態によりGnPが用いられる患者も想定されること、本邦がそうであるように薬剤の承認状況によっては使用できない地域もあり、全てを置き換えるものではないように思われる。本試験の比較には通常FOLFIRINOX療法が含まれていないことから、今回の差がFOLFIRINOX系レジメンとGnP療法の差なのか、Nal-IRIの薬剤固有のものなのか、についてのクエスチョンは残存し興味深い。本邦では、GnP療法とmodified FOLFIRINOX療法にS-IROX療法5)を加えた第II/III相試験が進行中であり6)、NAPOLI-3試験結果を再現する形になるかについても注目したい。
(レポート:国立がん研究センター中央病院 肝胆膵内科 大場 彬博)
References
- 1) Conroy T, et al.: N Engl J Med. 364(19):1817-1825, 2011 [PubMed]
- 2) Hoff DDV, et al.: N Engl J Med. 369(18): 1691-1703, 2013 [PubMed]
- 3) Wang-Gillam A, et al.: Lancet. 387(10018): 545-557, 2016 [PubMed]
- 4) Wainberg ZA, et al.: Eur J Cancer. 151: 14-24, 2021 [PubMed]
- 5) Ohba A, et al.: Eur J Cancer. 174: 40-47, 2022 [PubMed]
- 6) Mizusawa J, et al.: Jpn J Clin Oncol. 53(1): 80-84, 2022
関連サイト
- ・NAPOLI-3試験[ClinicalTrials.gov]
- ・PRODIGE 4/ACCORD 11試験[ClinicalTrials.gov][学会レポート]
- ・MPACT試験[ClinicalTrials.gov][学会レポート]
- ・NAPOLI-1試験[ClinicalTrials.gov]
- ・JCOG1611試験(GENERATE試験)[JCOG][JRCT]










寺島 健志先生
金沢大学 先進予防医学研究センター 特任准教授