胆道癌
進行胆道癌に対するGCN療法の第III相試験(SWOG 1815試験)
SWOG 1815: A phase III randomized trial of gemcitabine, cisplatin, and nab-paclitaxel versus gemcitabine and cisplatin in newly diagnosed, advanced biliary tract cancers
Rachna T. Shroff, et al.
Expert’s view
本試験は化学療法未治療の進行胆道癌患者を対象とし、GCN療法の有効性および安全性をGC療法と比較した海外第III相試験であった。主要評価項目に設定されたOSのKaplan-Meier曲線は、ランダム化後12ヵ月くらいまではGCN療法群が上に位置しており、GCN療法群およびGC療法群のOS中央値はそれぞれ14.0ヵ月および12.7ヵ月と、GCN療法群で良好であったものの、統計学的な有意差は認められなかった。副次評価項目に設定されたPFSも中央値で8.2ヵ月および6.4ヵ月、ORRが31%および22%といずれも統計学的な有意差は認められなかった。以上より、GCN療法のGC療法に対する優越性は検証されなかったと結論づけられている。
胆道癌に対する1次薬物療法として、GCN療法は第II相試験で高い有効性が報告されていただけに残念な結果であった。しかしながら、レポートで取り上げていただいたように本試験の部分集団解析の結果から、胆道癌に対する今後の治療開発に重要な情報が得られた。これまで胆道癌に対する薬物療法は、部位によらず肝内胆管癌、肝門部胆管癌、肝外胆管癌、胆?癌、十二指腸乳頭部癌を対象として行われてきた。しかし、GC+Durvalumab療法の有用性を示したTOPAZ-1試験や本試験では十二指腸乳頭部癌が除外されている。また、部分集団解析の結果、対照群のGC療法と比較して部位別で有効性が異なることが示唆されている。
本邦ではGCS療法に加えてGC+Durvalumab療法が承認され使用可能となった。また、GC+Pembrolizumab療法をGC療法と比較したKEYNOTE-966試験において、有意にOSが延長されたことがプレスリリースされている。GC療法が標準治療となって以降、長期間それを上回る治療法はなかったが、複数の選択肢の使い分けを議論できることとなった。各レジメンで上述の部位別に異なるのであれば、それが背景の臨床病理学的特徴や原因となる遺伝子変異、宿主免疫等、どのような要因によるものなのか、解析が進むことを期待したい。
(コメント・監修:金沢大学先進予防医学研究センター 特任准教授 寺島 健志)
胆道癌における殺細胞性抗癌薬の3剤併用療法の位置づけ
進行胆道癌に対する1次薬物療法としてはABC-02試験1)においてGemcitabine(GEM)単剤療法に対する全生存期間(OS)における優越性を示したGEM+Cisplatin(GC)療法が長らく国際的な標準治療となっていた。近年GC療法に対して抗PD-L1阻害薬であるDurvalumabの上乗せを示したTOPAZ-1試験の結果が報告され2)、本邦でも2022年12月に薬事承認が得られたため、自己免疫疾患などの注意に該当しない限りは順次標準治療としての普及が進んでいくものと思われる。一方で、胆道癌に対しては免疫療法や標的治療の開発のほかに、殺細胞性抗癌薬3剤併用療法による治療強度を高める取り組みが複数行われてきた。
本邦ではGC療法にS-1を上乗せするGCS療法が期待され、GC療法と比較した第III相試験であるMITSUBA試験(KHBO1401試験)が行われた。GCS療法はGC療法に対しOSにおける優越性を示し3)、少なくとも本邦では標準治療の1つに位置づけられた。フランスでは膵癌における開発と同様にmodified FOLFIRINOX療法の期待からGC療法と比較したランダム化第II/III相試験であるPRODIGE 38 AMEBICA試験が行われたものの、第II相部分の主要評価項目である6ヵ月無増悪生存割合はmodified FOLFIRINOX療法群が劣っており、その有効性を示すことができなかった4)。このように、これまでのところ殺細胞性抗癌薬3剤併用療法の意義は相反する結果が示されていた。
米国ではGC療法にNab-Paclitaxelを上乗せするGCN療法が注目され、既に単群の第II相試験では無増悪生存期間(PFS)中央値が11.8ヵ月(95% CI: 6.0-15.6)など良好な結果が報告されていた5)。この結果に基づきOSにおける有効性を検証するためにGC療法と比較する第III相試験であるSWOG 1815試験が実施された。
GC療法に対するOSにおける優越性を検証した第III相試験
本試験のデザインはOSを主要評価項目とした第III相試験で、GCN療法とGC療法には2:1割付が行われた。HR=0.7の差を見込み、片側α=0.025、検出力90%で評価する設定で、層別化因子としては、原発部位(肝内胆管癌、胆?癌、肝外胆管癌)、病期(局所進行、遠隔転移)、PSが採用されていた。PSは0または1で、組織学的診断は必須であり、乳頭部癌は対象に含まれていなかった。GCN療法の用量はGEM 800mg/m2、Cisplatin 25mg/m2、Nab-Paclitaxel 100mg/m2であり、GEMは通常GC療法より、Nab-Paclitaxelは膵癌のGEM+Nab-Paclitaxel療法より1段階少ない用量が用いられていた。9週ごとの画像評価が行われ、副次評価項目としてPFS、奏効割合(ORR)、病勢制御割合、安全性およびCA19-9変化が設定されていた。また、探索的に血液および組織検体が収集されていた。
OSにおける優越性は検証されず、今後、部位別や病期別の開発は必要か
解析対象はGCN療法群294例、GC療法群147例の計441例であった。原発部位では肝内胆管癌67%、胆?癌16%、肝外胆管癌17%であり、病期では遠隔転移73%、局所進行27%であった。
主要評価項目であるOSは、中央値がGCN療法群vs. GC療法群で14.0ヵ月vs. 12.7ヵ月(p=0.65)であり、統計学的な有意差は認めなかった(図)。副次評価項目のPFSは中央値8.2ヵ月vs. 6.4ヵ月(p=0.43)、ORRは31% vs. 22%(有意差なし)であった。ここまでの結果から本試験は全体集団としてGCN療法の有効性は検証されずnegativeであったといえる。ここから発表者らはサブグループ別の探索的解析に注目していくつかの解析結果を報告している。まず原発部位別の解析では、肝内胆管癌と肝外胆管癌では両群にほぼ差がなかったのに対し、胆?癌ではOS中央値17.0ヵ月vs. 9.3ヵ月でGCN療法群が良好な傾向があるとした(表)。同様に病期別では局所進行でOS中央値19.2ヵ月vs. 13.7ヵ月と同様の傾向を主張している。
Grade 3以上の有害事象についてはGCN療法群で高頻度となっており、好中球減少(37% vs. 28%)、貧血(33% vs. 22%)、下痢(5% vs. 1%)、末梢神経障害(4% vs. 1%)などであった。
以上の結果から、発表者らはGCN療法が進行胆道癌に対するOSにおける優越性を示せなかったとした上で、胆?癌や局所進行では有効な可能性があり、さらなる評価が期待されるとした。ディスカッサントは、同セクションで発表されたIMbrave151試験がGC+Atezolizumabに対してBevacizumabのPFSにおける上乗せを示せなかった点とあわせて“More Is Not Better”としていた。本試験では前述した通り胆?癌や局所進行は小さなサブグループであるため、これらの考察には既報のサブグループ解析でも同様の傾向がみられるか参照する必要があると思われる。胆?癌についてはPRODIGE 38試験で同様の傾向があるが(HR=1.55)、MITSUBA試験ではなく、局所進行についてもPRODIGE 38試験で3剤併用の効果が高まることはなさそうであり(MITSUBA試験データなし)、直ちに一般化できる傾向とはいえない。一方で、TOPAZ-1試験での胆?癌サブグループでDurvalumabの上乗せが少ない(HR=0.94)など開発の余地があることは想定される。
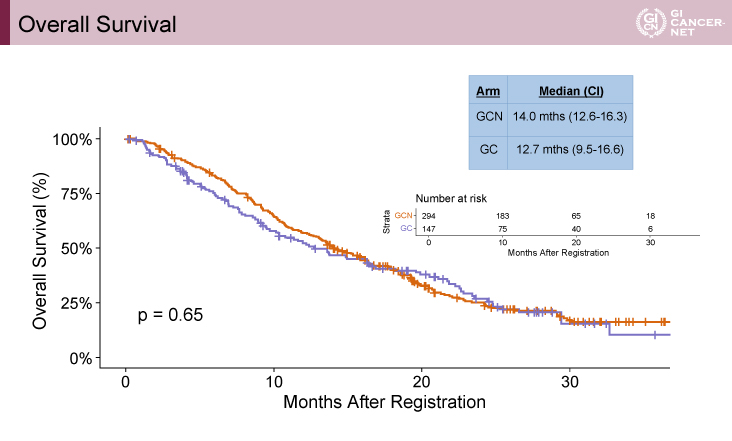
発表者の許可を得て掲載(approved by Rachna T. Shroff)
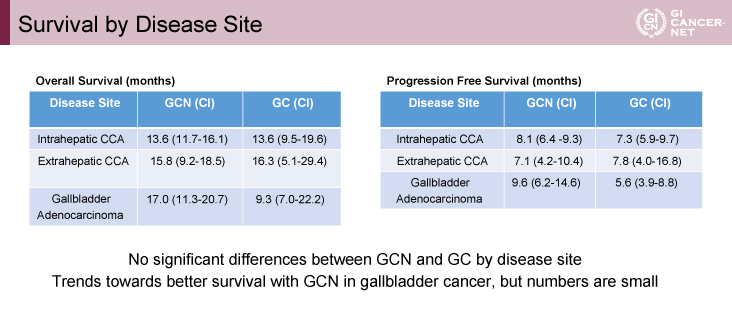
発表者の許可を得て掲載(approved by Rachna T. Shroff)
まとめ
OSにおけるGCN療法のGC療法に対する優越性は検証されなかった。米国では非常に期待されていたレジメンであり意外性もあったようであった。Modified FOLFIRINOX療法に続き本レジメンも優越性を示せなかったことから、国際的には胆道癌全体に対する殺細胞性抗癌薬3剤併用療法の開発は下火になっていくと思われる。本邦ではGCS療法の有効性、特に奏効割合の高さから術前化学療法としての開発がJCOG1920試験6)として進んでいるが、GCN療法も比較的ORRが高かったこと、局所進行のサブグループで有効な傾向であったこと、などからは術前化学療法やconversion surgeryを目指した戦略として評価されていくことは考えられる。部位別の開発については支持するエビデンスが豊富ではないことや実現可能性もあり、今後のバイオマーカー解析結果なども踏まえて検討していく必要があるように思われる。
(レポート:国立がん研究センター中央病院 肝胆膵内科 大場 彬博)
References
- 1) Valle J, et al.: N Engl J Med. 362(14): 1273-1281, 2010 [PubMed]
- 2) Oh DY, et al.: NEJM Evid. 1(8), 2022 [NEJM Evidence]
- 3) Ioka T, et al.: J Hepatobiliary Pancreat Sci. 30(1): 102-110, 2023 [PubMed]
- 4) Phelip JM, et al.: J Clin Oncol. 40(3): 262-271, 2022 [PubMed]
- 5) Shroff RT, et al.: JAMA Oncol. 5(6): 824-830, 2019 [PubMed]
- 6) Nara S, et al.: J Clin Oncol. 41(4_suppl): TPS621-TPS621, 2023 [JCO]
関連サイト
- ・SWOG 1815試験[SWOG]
- ・TOPAZ-1試験[ClinicalTrials.gov][学会レポート]
- ・KEYNOTE-966試験[ClinicalTrials.gov]
- ・ABC-02試験[ClinicalTrials.gov][学会レポート]
- ・MITSUBA試験(KHBO1401試験)[UMIN][学会レポート]
- ・PRODIGE 38 AMEBICA試験[ClinicalTrials.gov]
- ・IMbrave151試験[ClinicalTrials.gov][JCO]
- ・JCOG1920試験[JCOG][NIPH]










寺島 健志先生
金沢大学 先進予防医学研究センター 特任准教授