大腸癌
切除不能進行・再発大腸癌に対するFTD/TPI+BEV vs. FTD/TPIの無作為化比較第III相試験:SUNLIGHT試験
Trifluridine/tipiracil plus bevacizumab for third-line treatment of refractory metastatic colorectal cancer: The phase 3 randomized SUNLIGHT study
Josep Tabernero, et al.
Expert’s view
FTD/TPI+BEV療法は、大腸癌治療ガイドライン2022年版に後方治療の選択肢として既に掲載されている(推奨度2・エビデンスレベルB)が、現時点でどれくらいの医師が第一選択としているだろうか。今回、海外で行われたFTD/TPI+BEVの有効性が第III相試験の結果として確認された。本試験は、VEGF系阻害薬使用歴のない患者も含まれていた(24%)が、BEV使用例のあるサブグループでもOSハザード比の点推定値は0.72である。対照であるFTD/TPI群のOS中央値も7.5ヵ月と良好な中で、BEVによる十分な上乗せが示された。以上を鑑みると、日本不参加であったが、本SUNLIGHT試験の結果は本邦の実地診療に外挿できると考える。
FTD/TPI+BEV療法の安全性についても、大きな懸念は示されなかった。通常のFTD/TPI+BEV療法ではgrade 3以上の好中球減少の頻度が高い(46.9~72%)ことから、5投9休法(Bi-weeklyレジメン)も試みられている。ただし、SUNLIGHT試験は、あくまで従来投与法での有効性の確認であり、Bi-weeklyレジメンの有効性は現在JCOGで実施中の第III相試験(ROBiTS試験)に委ねられている。
私見だが、本試験の結果を受け、FTD/TPI+BEVは本邦の治療ガイドラインにおいて、推奨度1に格上げされるだろう。もちろん、ガイドラインの変更を待たずとも、明日からFTD/TPI+BEV療法を選択することもできる。後方治療のレジメン選択は、先のESMOで発表されたFruquintinibに加えて、今後Lenvatinib+Pembrolizumabの第III相試験や抗EGFR抗体薬リチャレンジの比較試験の結果も影響を受ける。俄然、後方治療の話題が充実してきた。
(コメント・監修:愛知県がんセンター 薬物療法部 医長 谷口 浩也)
FTD/TPI+BEVの有効性および安全性結果が第III相試験として初めて報告された
切除不能進行・再発大腸癌(mCRC)の後方ラインにおいてTrifluridine/Tipiracil塩酸塩(FTD/TPI)は、プラセボと比較した第III相試験(RECOURSE試験)の結果1)、有意な生存延長が示され標準治療となっている。一方、FTD/TPI+Bevacizumab(BEV)は単群による第II相試験のほか2,3)、無作為化比較第II相試験(Danish study)4)の結果、全生存期間(OS)中央値(FTD/TPI+BEV群9.4ヵ月vs. FTD/TPI群6.7ヵ月)、無増悪生存期間(PFS)中央値(4.6ヵ月vs. 2.6ヵ月)が示され、FTD/TPI単剤と比べて高い有効性が示唆された。この結果を検証することを目的にFTD/TPI+BEV vs. FTD/TPIの無作為化比較第III相試験(SUNLIGHT試験)が行われた。
FTD/TPIの投与法は28日間隔で計画された
主な選択基準は2レジメン以上の治療歴を有する、ECOG PS 0-1のmCRCであり、層別因子は地域、遠隔転移診断からの期間、RAS遺伝子変異の有無であった。患者は2群(FTD/TPI+BEV群、FTD/TPI群)に1:1で無作為に割り付けられた。FTD/TPIは35 mg/m2/回、1日2回、day 1-5、day 8-12、28日間隔とし、BEVは5 mg/kg、day 1、day 15とした。主要評価項目はOSであった。副次評価項目はPFS、客観的奏効割合(ORR)、病勢制御割合(DCR)、安全性およびQOL(time to deterioration)であった。統計設定において、検出力は90%とし、OSにおけるHR期待値は0.70とした(図1)。
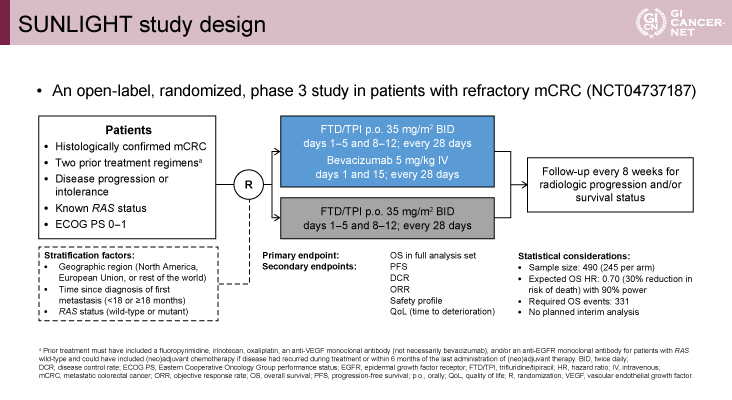
発表者の許可を得て掲載(approved by Josep Tabernero)
FTD/TPI+BEVの有効性および安全性が示された
2020年11月から2022年2月までの期間において492例が登録され、両群それぞれ246例が割り付けられた。患者背景(FTD/TPI+BEV群vs. FTD/TPI群)に偏りはなく、左側結腸75% vs. 69%、VEGF系阻害薬治療歴あり76% vs. 76%、RAS変異型70% vs. 69%であった(表1)。
主要評価項目であるOS中央値は、FTD/TPI+BEV群10.8ヵ月vs. FTD/TPI群7.5ヵ月(HR=0.61、95% CI: 0.49-0.77、p<0.001)とFTD/TPI+BEV群で有意な延長を認めた(図2)。PFS中央値は5.6ヵ月vs. 2.4ヵ月(HR=0.44、95% CI: 0.36-0.54、p<0.001)であった。OS、PFSともサブグループ解析では明らかな交互作用は認めなかった。ORRは6.3% vs. 0.9%(p=0.004)、DCRは76.6% vs. 47.0%(p<0.001)とFTD/TPI+BEV群が有意に優れていた。また、QOLに関して、global health statusが低下までの期間は8.5ヵ月vs. 4.7ヵ月(p<0.001)、ECOG PS 2に悪化するまでの期間は9.3ヵ月vs. 6.3ヵ月(HR=0.54、95% CI: 0.43-0.67、p<0.001)とFTD/TPI+BEV群が有意に優れる結果であった。
安全性に関して、grade 3以上の有害事象発現割合はFTD/TPI+BEV群72% vs. FTD/TPI群70%と同程度であった。減量割合は16% vs. 12%、投与延期割合は70% vs. 53%であった。FTD/TPI+BEV群で目立った副作用は高血圧(全grade 10% vs. 2%)、嘔気(全grade 37% vs. 27%)、好中球減少(全grade 42% vs. 51%、grade 3/4 43% vs. 32%)であったが、発熱性好中球減少症はFTD/TPI+BEV群で1例、FTD/TPI群で 6例であった(表2)。
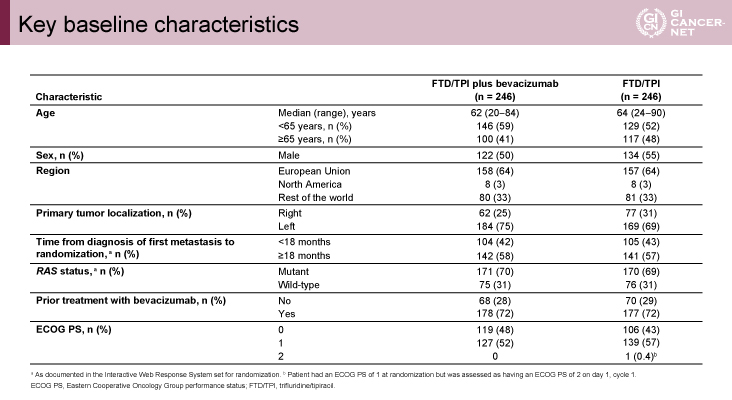
発表者の許可を得て掲載(approved by Josep Tabernero)
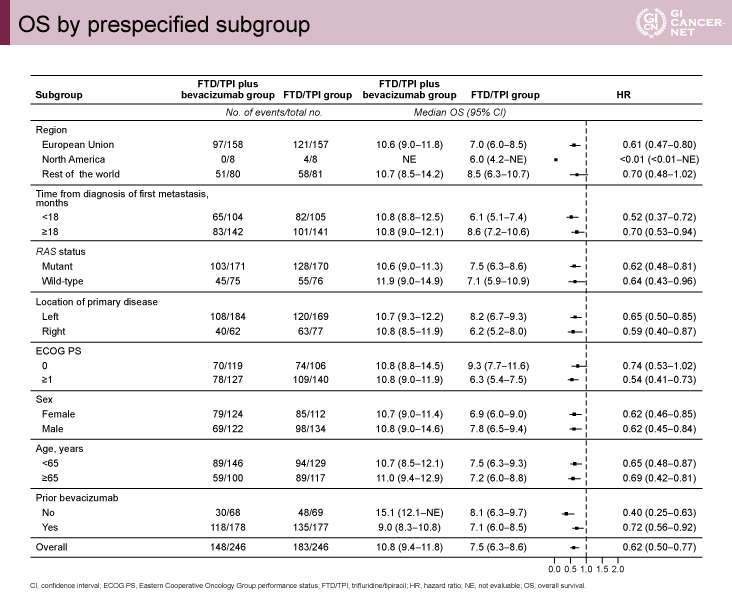
発表者の許可を得て掲載(approved by Josep Tabernero)
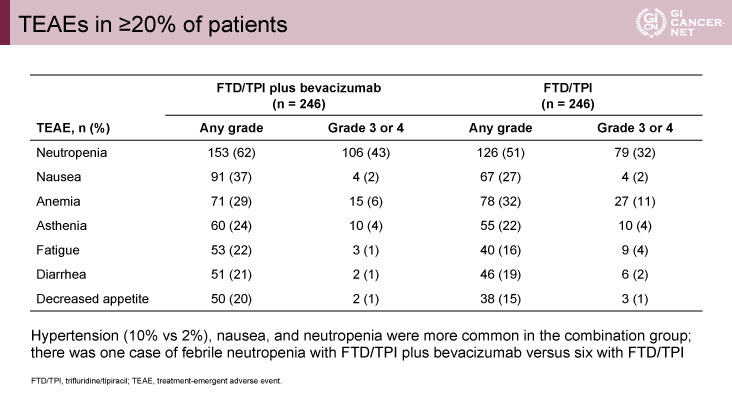
発表者の許可を得て掲載(approved by Josep Tabernero)
結論
FTD/TPI+BEVのOS中央値は10.8ヵ月が示され、FTD/TPIと比較して統計学的に有意な生存延長(3.3ヵ月)を認め、死亡リスクは39%低下した。その他、PFS、QOL、ORR、DCRのいずれにおいてもFTD/TPI+BEVが優れる結果であり、FTD/TPI+BEVによる有害事象は管理可能であった。FTD/TPI+BEVは、mCRCの後方ライン治療において、有効かつ忍容性のある新しい標準治療であることが示された。
(レポート:愛知県がんセンター 薬物療法部 児玉 紘幸)
References
- 1) Mayer RJ, et al.: N Engl J Med. 372(20): 1909-1919, 2015 [PubMed]
- 2) Kuboki Y, et al.: Lancet Oncol. 18(9): 1172-1181, 2017 [PubMed]
- 3) Yoshida Y, et al.: Int J Clin Oncol. 26(1): 111-117, 2021 [PubMed]
- 4) Pfeiffer P, et al.: Lancet Oncol. 21(3): 412-420, 2020 [PubMed]
関連サイト
- ・SUNLIGHT試験 [ClinicalTrials.gov]
- ・RECOURSE試験 [ClinicalTrials.gov] [学会レポート]
- ・ROBiTS試験 [JCOG]
- ・Fruquintinib [論文紹介]










谷口 浩也先生
愛知県がんセンター 薬物療法部 医長