大腸癌
一次治療としてmFOLFOXIRI+CetuximabとmFOLFOXIRI+Bevacizumabを比較した第II相試験(DEEPER試験:JACCRO CC-13)のRAS/BRAF野生型切除不能進行再発大腸癌に対する生存解析
Modified(m)-FOLFOXIRI plus cetuximab versus m-FOLFOXIRI plus bevacizumab as initial treatment of patients with unresectable RAS and BRAF wild-type metastatic colorectal cancer: Survival analysis of the phase II randomized DEEPER trial by JACCRO
Yu Sunakawa, et al.
Expert’s view
RAS/BRAF野生型・左側原発の切除不能進行再発大腸癌に対する1次治療の“標準オプション”になる可能性
DEEPER試験(JACCRO CC-13)は、プライマリーエンドポイントであるper protocol setのDepth of Response(DpR)において、modified(m)-FOLFOXIRI+Cetuximab療法がBevacizumab療法よりも有意に良好であることが2021年の米国臨床腫瘍学会で報告されている1)。試験はpositiveであり、m-FOLFOXIRI+Cetuximab療法が新たな治療レジメンとして大腸癌治療ストラテジーに組み入れられることが期待された。しかし、まだ生存に関するデータが発表されておらず、このレジメンの臨床応用はほとんどされていなかった。
今回は、セカンダリーエンドポイントの無増悪生存期間(PFS)に関する結果の報告であり、DEEPER試験の初めての生存解析の結果である。
イタリアのグループで行われたTRIPLETE試験(m-FOLFOXIRI+Panitumumab vs. m-FOLFOX6+Panitumumab)では、奏効率、DpRともに両群で有意差がなく、PFSも差がなかった2)。さらに、日本から発表されたPARADIGM試験においても、RAS野生型・左側原発症例においてPanitumumab群とBevacizumab群にPFSの差は認めなかった3)。
そんな中、DEEPER試験では、RAS/BRAF野生型・左側原発の症例において、Cetuximab群のPFS中央値が有意に長く、抗EGFR抗体薬とBevacizumabの比較試験において初めて前向きに、抗EGFR抗体薬治療がPFSにおいて良いことが示されたといえる。R0切除率も高く、レジメンの腫瘍縮小のパワーが臨床結果に反映されたといえるであろう。
また、本試験ではDpRとPFSが相関することが前向きに示されている。切除不能進行再発大腸癌では、化学療法によりDpRと全生存期間が相関することが報告されている。そのエビデンスを踏まえると、今後、DEEPER試験の全生存期間の解析結果が待ち遠しい。しかし、今回の結果から、m-FOLFOXIRI+Cetuximab療法は高い割合のDpR、長いPFSを考えれば、RAS/BRAF野生型・左側原発の切除不能進行再発大腸癌に対する“標準1次治療オプション”として考えてよいであろう。
(コメント・監修:聖マリアンナ医科大学 臨床腫瘍学 主任教授 砂川 優)
背景:切除不能進行再発大腸癌におけるDpRと臨床転帰について
FOLFOXIRI+Bevacizumab(BEV)は切除不能進行再発大腸癌の1次治療の標準治療の1つであるが、FOLFOXIRI+抗EGFR抗体薬はVOLFI試験やMACBETH試験において最大腫瘍縮小率(DpR: depth of response)がより高いことが報告されている4,5)。また、複数の後方視研究においてDpRは切除不能進行再発大腸癌の予後と相関していることが示されており、DpRは予後予測因子となる可能性が示唆されている。本邦で行われたDEEPER試験(JACCRO CC-13)では、切除不能進行再発大腸癌の1次治療のm-FOLFOXIRI+Cetuximab(CET)はm-FOLFOXIRI+BEVと比べてDpRが有意に高いことがすでに示されている1)。今回の報告では、DEEPER試験における生存解析が行われた。
DEEPER試験(JACCRO CC-13)の対象と方法
本試験は、未治療のRAS野生型切除不能進行再発大腸癌を対象として1次治療のm-FOLFOXIRI+CET(試験治療群)とm-FOLFOXIRI+BEV(対照群)を比較した本邦の多施設共同無作為化第II相試験である。主な適格基準は、腺癌、標的病変あり(RECIST v1.1)、20歳以上、PS 0-1(71歳以上はPS 0のみ)であった。層別化因子は、原発部位(右側/左側)、術後補助化学療法歴の有無、ECOG PS(0/1)であった。主要評価項目はper protocol set(PPS)におけるDpRで、副次評価項目は客観的奏効率(ORR: objective response rate)、無増悪生存期間(PFS: progression-free survival)、全生存期間、根治切除移行率、有害事象であった。生存に関する解析は、患者の最終登録から3年後の時点において2つの治療を原発部位(右側/左側)ごとに解析することが事前設定された。なお、サブグループ解析のためBRAF statusのデータが事後収集された。
結果:左側のRAS/BRAF野生型のサブグループにおいてm-FOLFOXIRI+CETは有意にPFSが良好
適格基準を満たした計359例が登録され、mFOLFOXIRI+BEV群(以下、BEV併用群)とmFOLFOXIRI+CET群(以下、CET併用群)に1:1で無作為に割り付けされた。最終的に各々162例、159例がPPSとして解析対象となった(図1)。両群の患者背景に偏りはなく、年齢の中央値は65歳、結腸原発が約57%、左側原発が約84%、ECOG PS 0が約90%であった(表1)。
主要評価項目のDpRは、BEV併用群で46.0%、CET併用群で57.3%(p=0.0029)であり、PFS中央値は各々12.3ヵ月、13.0ヵ月(HR[hazard ratio]=0.89、95% CI[confidence interval]: 0.70-1.12、p=0.32)であった。全体の約84%にあたる左側のサブグループでは、各々12.1ヵ月、13.8ヵ月(HR=0.80、95% CI: 0.62-1.04、p=0.090)であり、左側のうちRAS/BRAF野生型が判明しているサブグループにおいては各々11.7ヵ月、15.3ヵ月(HR=0.68、95% CI: 0.47-0.98、p=0.036)であり、有意にCET併用群でPFSが長かった(図2)。解析対象が抗EGFR抗体薬の期待できる集団に絞られるほどPFSのHRが低下するという結果であった。
Grade 3以上の主な有害事象(BEV併用群vs. CET併用群)は、好中球減少(54.5% vs. 56.0%)、発熱性好中球減少症(10.8% vs. 8.6%)、食欲不振(10.8% vs. 12.0%)、悪心(6.3% vs. 6.3%)、下痢(8.0% vs. 12.0%)、高血圧(33.5% vs. 17.7%)、ざ瘡様皮疹(0% vs. 13.1%)、爪周囲炎(0% vs. 11.4%)であり、骨髄抑制や消化器毒性は概ね同程度であり、高血圧はBEV群、皮膚毒性はCET群で多いものの、管理可能な有害事象プロファイルであった。
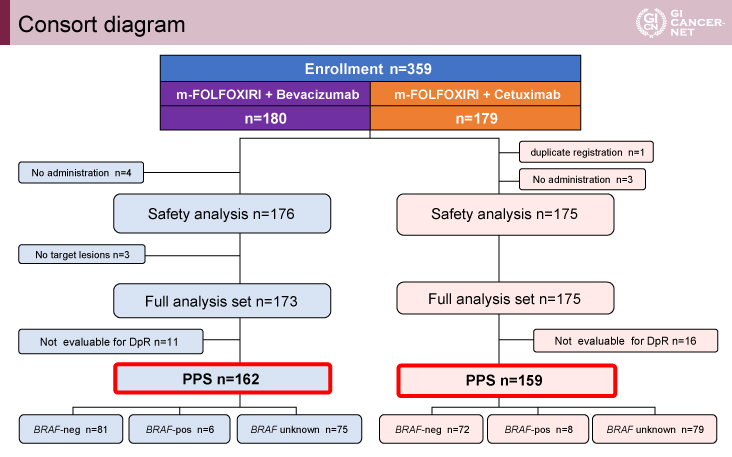
発表者の許可を得て掲載(approved by Yu Sunakawa)
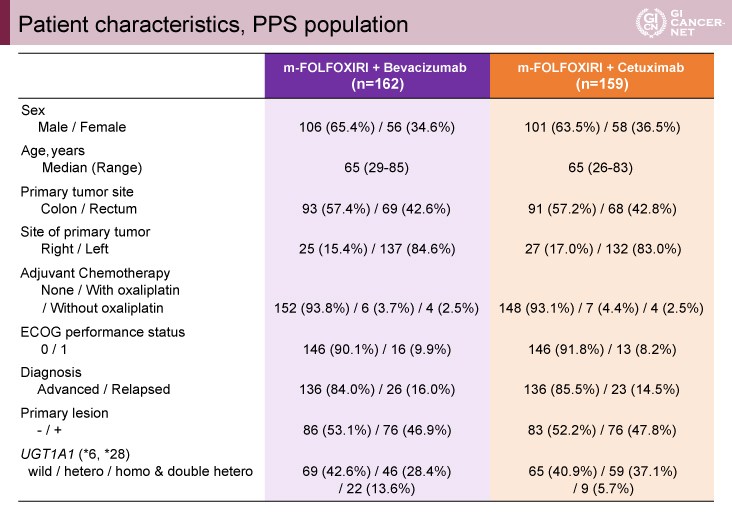
発表者の許可を得て掲載(approved by Yu Sunakawa)
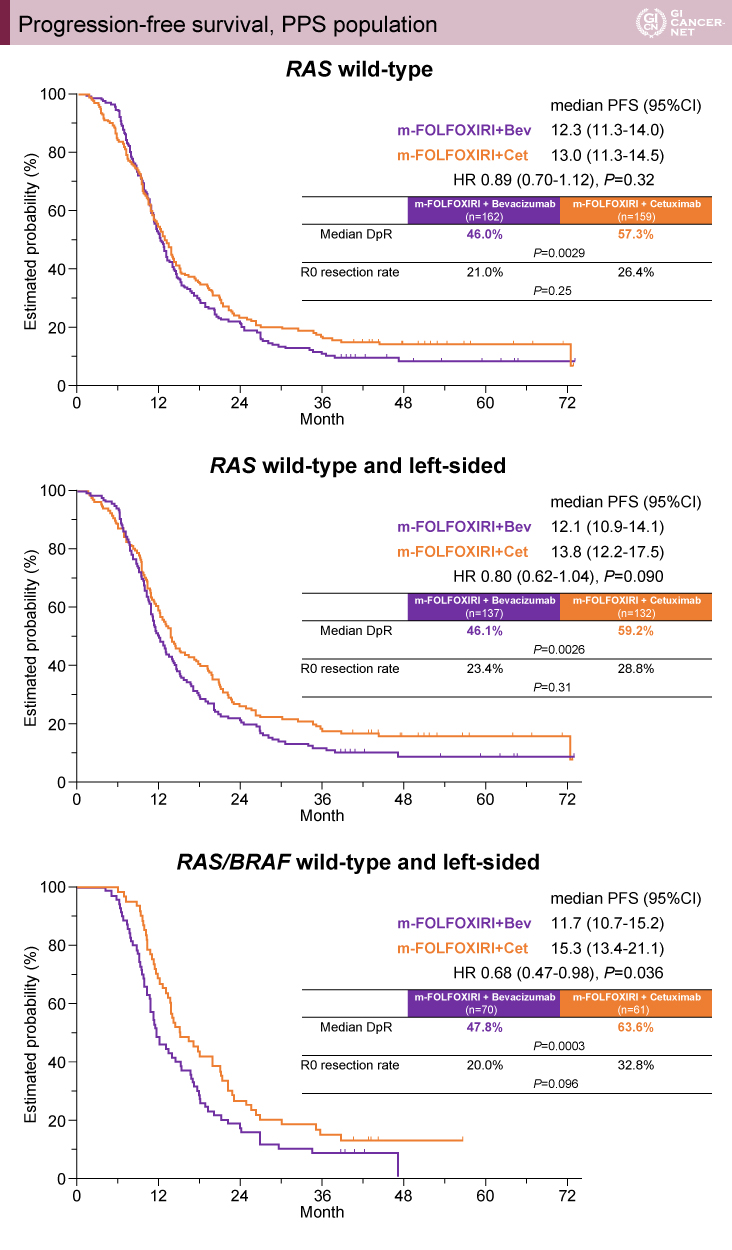
発表者の許可を得て掲載(approved by Yu Sunakawa)
まとめ
DEEPER試験の生存解析において、左側のRAS/BRAF野生型のサブグループでは、m-FOLFOXIRI+BEVと比較してm-FOLFOXIRI+CETのPFSが有意に長いことが示された。本結果から、高いDpRが良好なPFSに繋がることも示された。
以上より、m-FOLFOXIRI+CETは、左側のRAS/BRAF野生型の切除不能進行再発大腸癌の初回治療として良い選択肢となることが期待される。現在、組織を用いたバイオマーカー解析(マルチオミクス解析)が進行中、かつ、より多くのRAS/BRAF野生型の集団における追加の生存解析が予定されており、追加報告が待たれる。
(レポート:聖マリアンナ医科大学 臨床腫瘍学 久保田 洋平)
References
- 1) Tsuji A, et al.: J Clin Oncol. 39(15_suppl): 3501-3501, 2021 [JCO]
- 2) Cremolini C, et al.: J Clin Oncol. 40(17_suppl): LBA3505-LBA3505, 2022 [JCO]
- 3) Yoshino T, et al.: J Clin Oncol. 40(17_suppl): LBA1-LBA1, 2022 [JCO]
- 4) Modest DP, et al.: J Clin Oncol. 37(35): 3401-3411, 2019 [PubMed]
- 5) Cremolini C, et al.: JAMA Oncol. 4(4): 529-536, 2018 [PubMed]
関連サイト
- ・DEEPER試験 [ClinicalTrials.gov] [学会レポート]
- ・TRIPLETE試験 [ClinicalTrials.gov] [学会レポート]
- ・PARADIGM試験 [UMIN-CTR] [学会レポート]
- ・VOLFI試験 [ClinicalTrials.gov] [学会レポート(ESMO 2018)] [学会レポート(ESMO 2017)]
- ・MACBETH試験 [ClinicalTrials.gov]










砂川 優先生
聖マリアンナ医科大学 臨床腫瘍学 主任教授