胃癌
食道癌
HER2陽性進行胃食道腺癌に対する一次治療としてのZanidatamab併用療法の有効性と安全性:第III相試験(HERIZON-GEA-01)の一次解析結果
Zanidatamab + chemotherapy ± tislelizumab for first-line HER2-positive locally advanced, unresectable, or metastatic gastroesophageal adenocarcinoma: Primary analysis from HERIZON-GEA-01
Elena Elimova, et al.
Expert’s view
新しい抗HER2薬、二重特異性抗体Zanidatamabの有効性を検証する重要な試験が報告された。現在のHER2陽性胃癌に対する標準治療はCPS<1であればchemo+Trastuzumab、CPS≧1であればchemo+Trastuzumab+Pembrolizumabである。HERIZON-GEA-01試験の標準治療群に免疫チェックポイント阻害薬(ICI)が含まれていないが、これによってCPS≧1症例においてICI併用療法との比較ができないものの、HER2陽性胃癌全体でZanidatamabの有効性を評価することが可能となっている。
Triplet(chemo+Zanidatamab+Tislelizumab)とchemo+Trastuzumabの比較に関して、KEYNOTE-811試験との比較がポイントになる。使用する薬剤や対象の違い等があり一概に比較することはできないが、PFSにおいて本試験のHR=0.63(中央値12.4 vs. 8.1)、KEYNOTE-811試験のHR=0.73(中央値10.0 vs. 8.1)、OSにおいて本試験のHR=0.72(中央値26.4 vs. 19.2)、KEYNOTE-811試験のHR=0.80(中央値20.0 vs. 16.8)であった。本試験ではPD-L1 statusにかかわらず、PD-L1陰性相当でもICI併用群の成績が良かったが、測定した検査がTAPであること、食道腺癌が含まれていることが影響している可能性がある。また、治療成績だけではなく毒性の違いがあり、tripletでは消化器毒性の頻度が数値として高く、特に下痢の頻度が高い。下痢はマネジメント可能な毒性と報告されているが、臨床導入においては重要なポイントになるだろう。
Doublet(chemo+Zanidatamab)とchemo+Trastuzumabの比較に関して、PFSは有意にdoubletが良かったがOSは統計学的な有意差は示されなかった。しかし、臨床的には有意な差と考えられそうであり、ICIを併用しないdoubletで十分である可能性を抱かせる。今後、探索的でもtripletとdoubletの比較結果が出てくれば注視していくべきである。
(コメント・監修:聖マリアンナ医科大学 臨床腫瘍学講座 主任教授 砂川 優)
抗HER2二重特異性抗体ZanidatamabはTrastuzumabを超えるか
HER2陽性の進行胃癌/食道胃接合部癌の一次治療は、2010年のToGA試験の結果に基づき、Trastuzumabと化学療法の併用療法が長らく標準治療とされてきた1)。近年、HER2阻害とPD-1阻害の相乗効果を期待した免疫チェックポイント阻害薬の上乗せ戦略が注目され、KEYNOTE-811試験において、Pembrolizumabの追加が無増悪生存期間(PFS)および全生存期間(OS)を改善することが示された。しかし、同試験ではPD-L1発現によってベネフィットが一様ではなく、CPS(combined positive score)1以上の集団ではOS延長が示された一方、CPS 1未満の集団ではOS延長が明確でなかった2)。こうした背景から、2025年5月にHER2陽性かつCPS 1以上の進行胃癌/食道胃接合部癌の一次治療として、Pembrolizumab+Trastuzumab+化学療法が薬事承認された。
Zanidatamabは、HER2の2つの異なる細胞外ドメインに同時に結合する二重特異性抗体である。受容体クラスター形成と受容体内在化を誘導して細胞表面HER2発現を低下させるとともに、抗体依存性細胞傷害(ADCC)、抗体依存性細胞貪食(ADCP)、補体依存性細胞傷害(CDC)などの免疫エフェクター機構を強力に活性化する点が特徴とされる。
HER2陽性の進行胃食道腺癌を対象に一次治療におけるZanidatamab+化学療法(CAPOXまたはFP)の有効性を検証した第II相試験(NCT03929666)では、奏効率(ORR)75%、PFS中央値12.0カ月と、従来の標準治療を上回る可能性を示す成績が報告された3)。これらを背景に、標準治療(Trastuzumab+化学療法)を対照として、Zanidatamab+化学療法、さらにFc領域を最適化した抗PD-1抗体Tislelizumabを加えたZanidatamab+Tislelizumab+化学療法が、新たな標準治療となり得るかを検証する第III相試験として、HERIZON-GEA-01が実施された。
HERIZON-GEA-01はどう設計されたか:3群比較と逐次検定
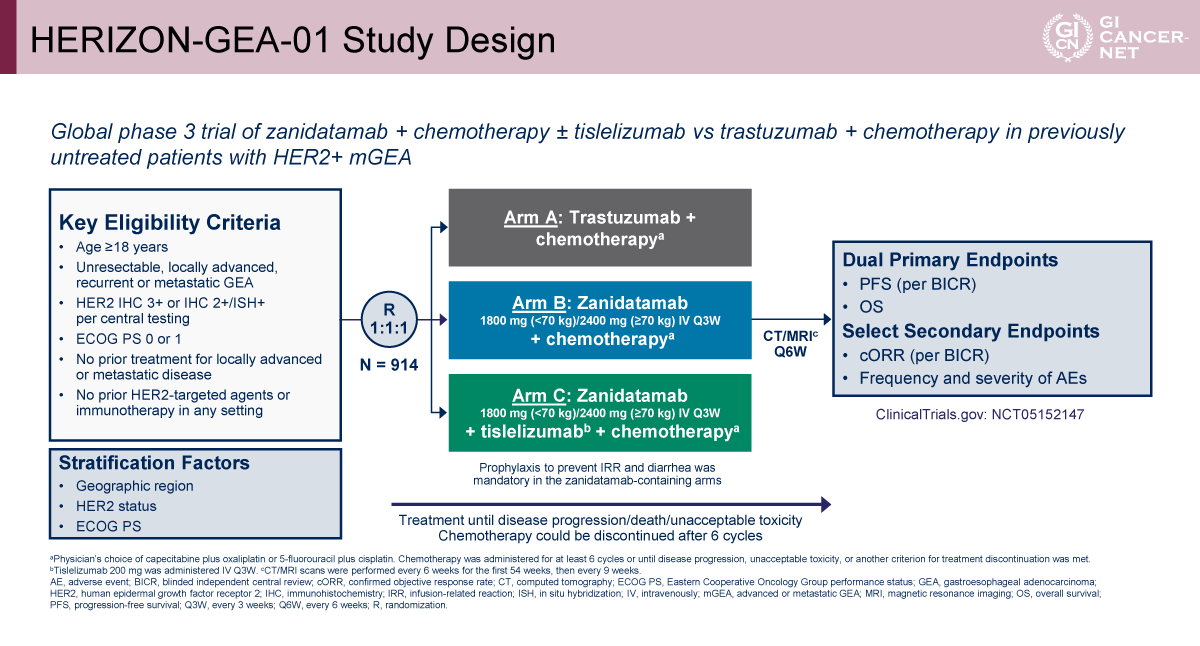
HERIZON-GEA-01は、未治療のHER2陽性の切除不能局所進行または転移性の胃食道腺癌(胃腺癌、食道胃接合部腺癌、食道腺癌)を対象とした、グローバル第III相無作為化比較試験である(図1)。登録に際してPD-L1発現は問わなかった。主な適格基準は、18歳以上、中央判定でHER2 IHC 3+またはIHC 2+/ISH+、ECOG PS 0-1で、局所進行/転移性に対する前治療がないこと、ならびにHER2標的薬または免疫療法の既治療がないこととされた。
対象は計914例で、Trastuzumab+化学療法(A群)、Zanidatamab+化学療法(B群)、Zanidatamab+Tislelizumab+化学療法(C群)の3群に1:1:1に無作為に割り付けられた。
層別化因子は地域、HER2 status、ECOG PSであった。化学療法はCAPOXまたは5-FU+Cisplatin(FP)のいずれかを医師が選択した。治療は病勢進行、死亡、または許容できない毒性が生じるまで継続し、化学療法は6サイクル後に中止可能とした。
主要評価項目は、盲検下独立中央判定(BICR)によるPFSおよびOSのデュアル・プライマリーエンドポイントとした。副次評価項目にはBICRによる奏効率(confirmed ORR)、および有害事象の頻度・重症度などが含まれた。解析はITT集団で行い、主要評価項目はlog-rank検定を用い、多重性を制御するため、fixed-sequence testing(逐次検定手順)を採用した(図2)。最初にPFSをC群 vs. A群、続いてB群 vs. A群の順に検定し、両比較で有意性が確認された場合にのみOSの検定へ進む設計とした。OSも同様にC群 vs. A群、次いでB群 vs. A群の順に検定し、それらが成立した場合にC群 vs. B群のOS比較が計画された。有意水準は、PFSの主要解析で両側α=0.05、OSの第1回中間解析では両側α=0.020と設定した。
発表者の許可を得て掲載(approved by Elena Elimova)

発表者の許可を得て掲載(approved by Elena Elimova)
Zanidatamab+Tislelizumab+化学療法はTrastuzumab+化学療法を全生存期間で有意に上回る
本試験では計914例が無作為化され、A群308例、B群304例、C群302例に割り付けられた。追跡期間中央値はA群25.8カ月、B群26.0カ月、C群25.9カ月で群間に差はなかった。患者背景は3群間で大きな偏りは認められず、地域はアジア/欧米/その他がおよそ5:3:2、原発部位は胃/食道胃接合部/食道がおよそ7:2:1の割合であった。HER2はIHC 3+は約8割を占めた。PD-L1はTAP(tumor area positivity)スコアで評価され、≧1%が約6割、<1%が約3割で、7.1%は不明であった。併用化学療法はCAPOXが約9割と大半を占めていた。
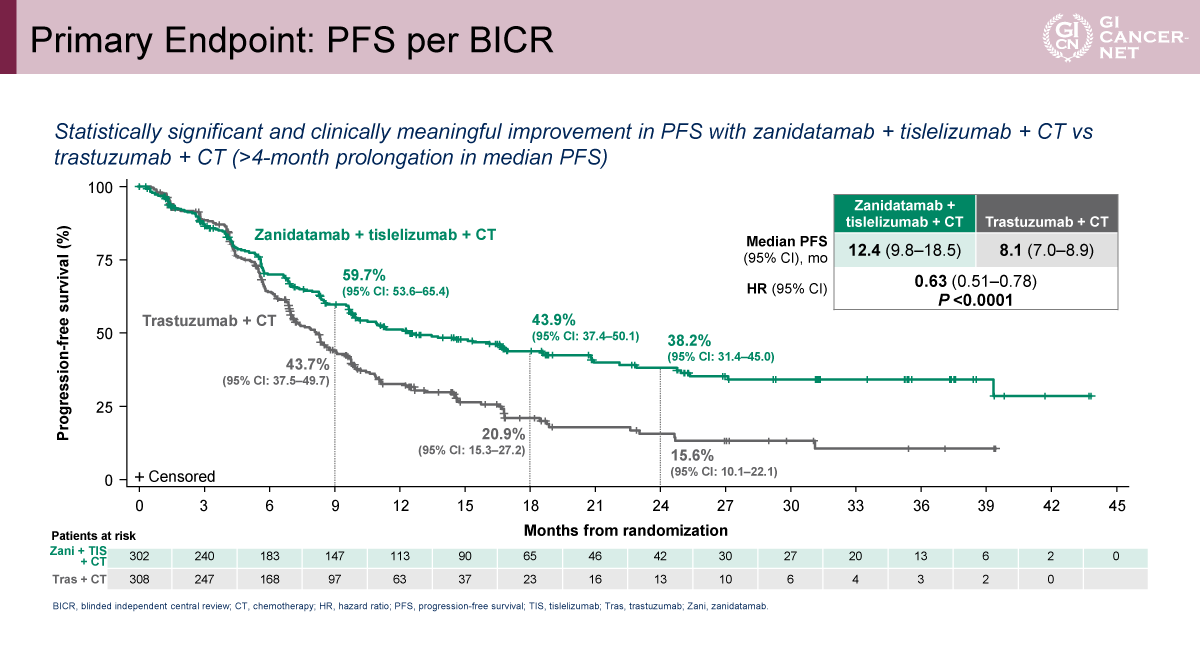
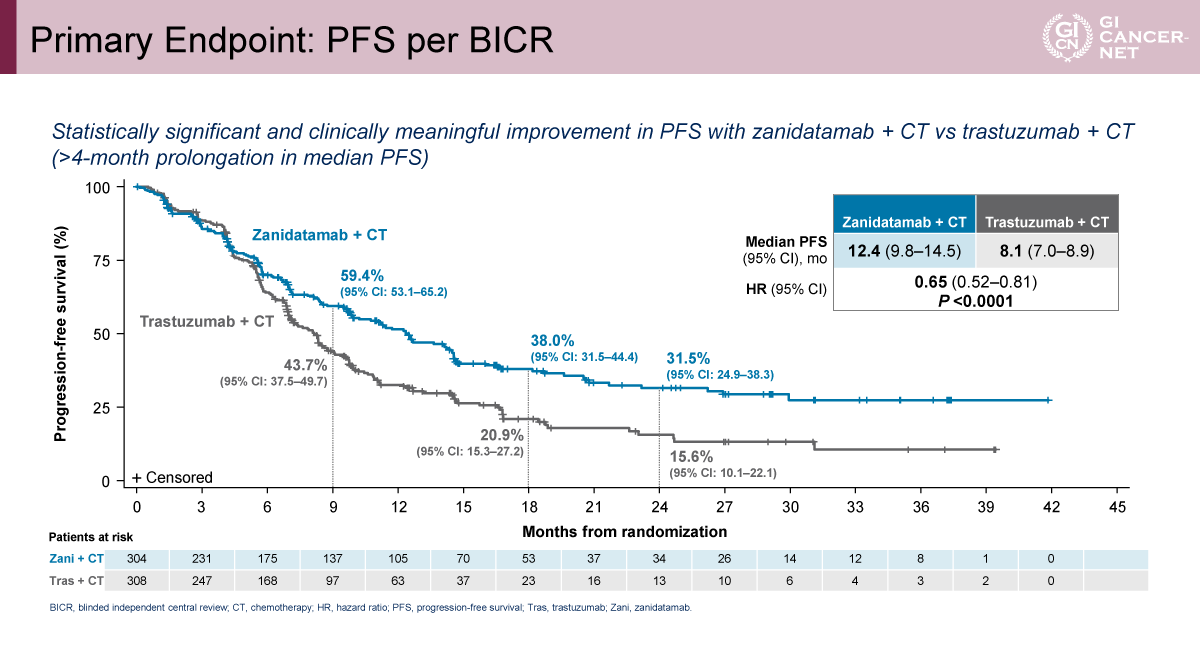
主要評価項目であるBICRによるPFSは、Zanidatamabを含む両群において、Trastuzumab併用群と比較して統計学的に有意かつ臨床的に意義のある延長が認められた。C群では中央値12.4カ月で、A群の8.5カ月に比べて有意に延長し(HR=0.63[95% CI: 0.51-0.78]、p<0.0001)(図3)、B群においても中央値12.4カ月と、A群に対して有意な改善が示された(HR=0.65[95% CI: 0.52-0.81]、p<0.0001)(図4)。すなわち、Zanidatamabを含むいずれのレジメンにおいても、中央値で約4カ月のPFS延長が認められた。
サブグループ解析では、年齢、地域、ECOG PS、原発部位、PD-L1 TAPスコア(<1%および≧1%)、化学療法レジメン(CAPOXおよびFP)といった主要因子において、PFSの改善は概ね一貫して観察された。とくにPD-L1低発現(TAP<1%)の集団でも、C群 vs. A群でHR=0.47(95% CI: 0.32-0.69)、B群 vs. A群でHR=0.62(95% CI: 0.44-0.87)と、Zanidatamab併用群における有効性が示され、PD-L1発現に依存しない上乗せ効果が示唆された。
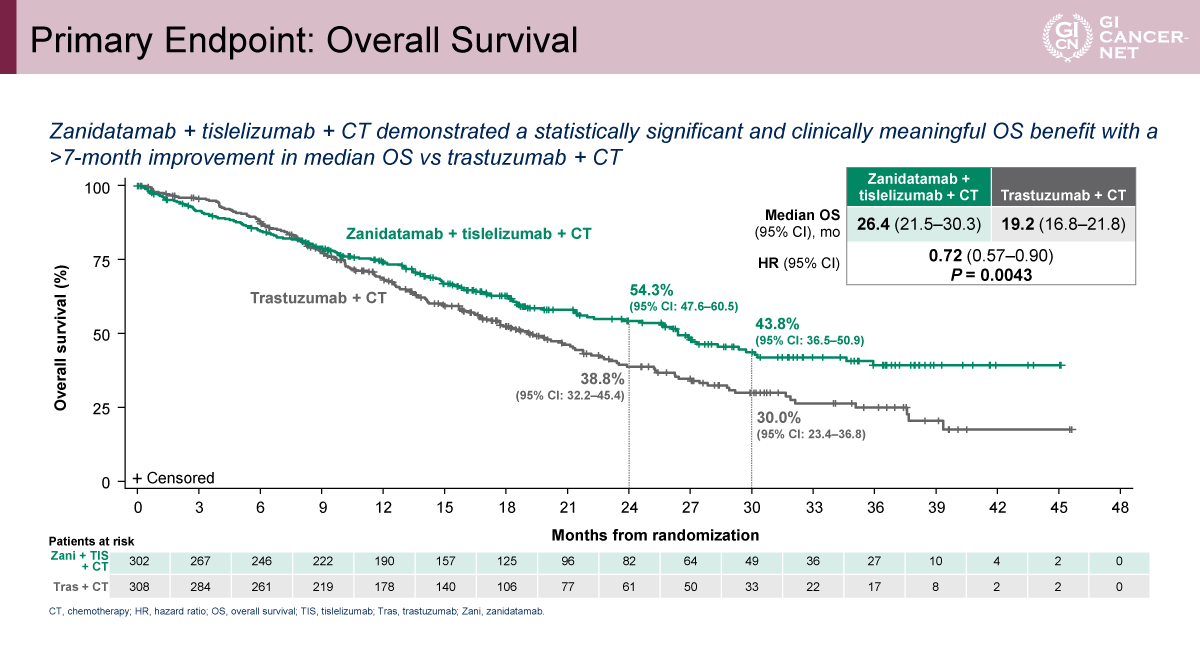
もう一つの主要評価項目であるOSについては、C群が中央値26.4カ月で、A群の19.2カ月に対し有意な延長を示し(HR=0.72[95% CI: 0.57-0.90]、p=0.0043)、中央値で約7カ月の改善が得られた(図5)。一方、B群は中間解析時点で中央値24.4カ月であり、A群に対するHRは0.80(95% CI: 0.64-1.01)、p=0.0564と有意水準には未到達であったものの、OS改善の傾向が認められた(図6)。OSのサブグループ解析においても、地域やPD-L1 TAPスコアを含む主要因子を横断して改善傾向が示された。
副次評価項目であるconfirmed ORRは、A群65.7%、B群69.6%、C群70.7%で、Zanidatamabを含む群で高い奏効率が得られた。完全奏効(CR)率もA群11.0%、B群17.1%、C群19.6%と、Zanidatamabを含む群で高い傾向がみられた。奏効持続期間(DOR)中央値はA群8.3カ月、B群14.3カ月、C群20.7カ月であり、Zanidatamabを含むレジメンでは奏効がより長く持続した。
安全性については、全体として既知の各薬剤プロファイルと同様で、新規の安全性シグナルは認められなかった。しかし、grade 3以上の治療関連有害事象はA群59.6%、B群59.0%、C群71.8%であり、C群で頻度が高い傾向にあった(表1)。とくにgrade 3以上の下痢はA群12.9%、B群20.0%、C群24.5%で、A群からC群にかけて段階的に増加した。下痢に起因する治療関連の中止もA群1.7%、B群4.9%、C群7.5%と、同様の増加傾向がみられた(表2)。治療関連の下痢は概ね治療開始後約1週間で発現し、多くは3週以内に軽快する傾向が示された。Zanidatamabを含む治療群では、プロトコルで初回7日間の予防的Loperamide投与が必須とされていた。
発表者の許可を得て掲載(approved by Elena Elimova)
発表者の許可を得て掲載(approved by Elena Elimova)
発表者の許可を得て掲載(approved by Elena Elimova)
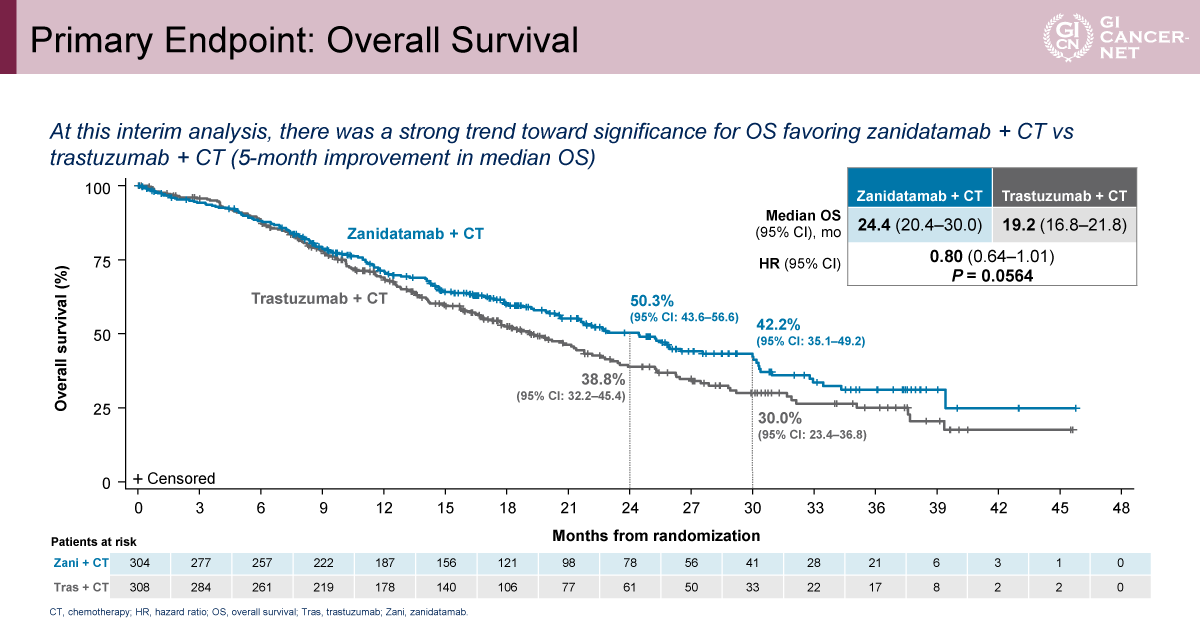
発表者の許可を得て掲載(approved by Elena Elimova)
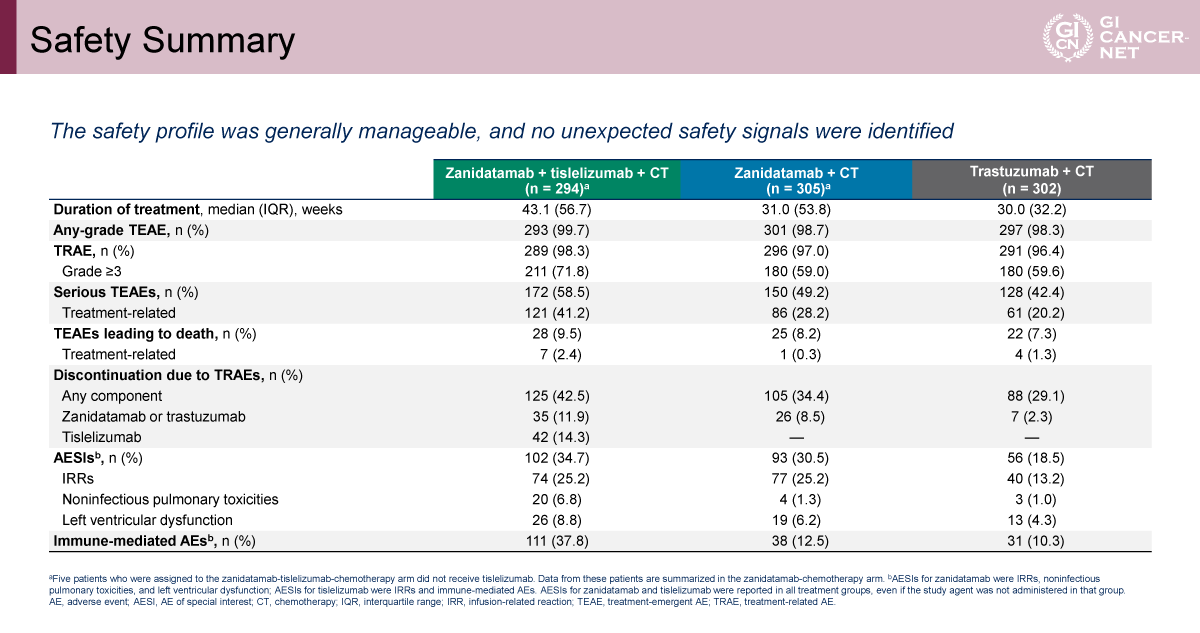
発表者の許可を得て掲載(approved by Elena Elimova)
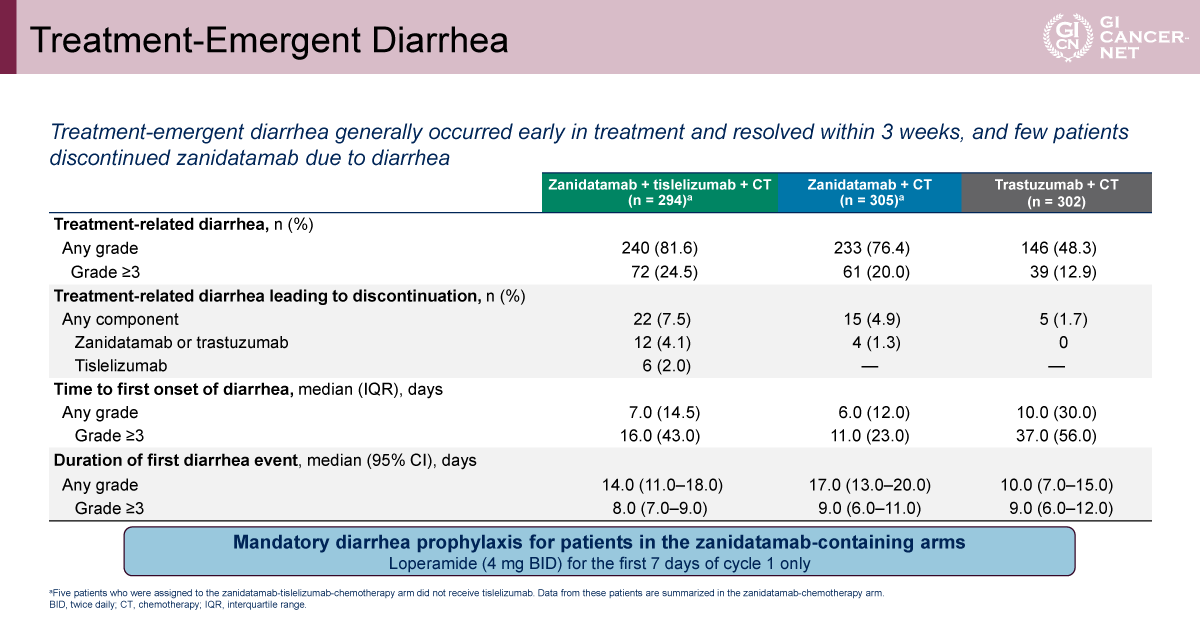
発表者の許可を得て掲載(approved by Elena Elimova)
Zanidatamab+Tislelizumab+化学療法はHER2陽性進行胃食道腺癌一次治療の新たな標準となり得る
HERIZON-GEA-01の一次解析により、Zanidatamabを併用する治療戦略は、HER2陽性進行胃食道腺癌の一次治療において、従来のTrastuzumab併用化学療法を上回る有効性を示した。とくにZanidatamab+Tislelizumab+化学療法は、PFSを有意かつ臨床的に意味のある水準で延長するとともに、OSにおいても統計学的に有意な改善を達成し、中央値で2年以上の生存を示した点は、本領域で初めて得られた重要な結果である。さらに、PD-L1低発現例を含む主要なサブグループで一貫したベネフィットが確認され、PD-L1発現に依存しない治療効果が示唆された。
一方で、安全性については既知の各薬剤プロファイルと同様であるものの、Zanidatamabを含む治療では下痢の発現頻度が高く、重症例や治療中止に至る症例も一定数認められた。下痢の有害事象は多くが治療早期に出現し、予防的投与や支持療法を含む適切な副作用マネジメントが推奨された。
まとめ
以上より、Zanidatamab+Tislelizumab+化学療法は、HER2陽性進行胃食道腺癌の一次治療における新たな標準治療となり得る有力な選択肢であり、今後の長期追跡および追加解析により、その位置づけがさらに確立されることが期待される。
(レポート:聖マリアンナ医科大学 臨床腫瘍学講座 武田 弘幸)
References
- 1) Bang YJ, et al.: Lancet. 376(9742): 687-697, 2010 [PubMed]
- 2) Janjigian YY, et al.: Lancet. 402(10418): 2197-2208, 2023 [PubMed]
- 3) Elimova E, et al.: Lancet Oncol. 26(7): 847-859, 2025 [PubMed]
関連サイト
- ・HERIZON-GEA-01試験[ClinicalTrials.gov]
- ・KEYNOTE-811試験[ClinicalTrials.gov][論文紹介][ASCO 2021学会レポート]










砂川 優先生
聖マリアンナ医科大学 臨床腫瘍学講座 主任教授